13.化学实验在学科中有举足轻重的作用,结合下列实验的图示分析相关的描述正确的是( )
| A. |  根据用电器(G)中指针的偏转方向可比较Zn、Cu的金属的氧化性 | |
| B. |  根据右侧小试管中液面的变化,可以判断铁钉发生了析氢腐蚀 | |
| C. |  测定中和热 | |
| D. |  根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断2NO2(g)?N2O4(g)是一个放热反应 |
12.下列说法不正确的是( )
| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全灭活该病毒感染性,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | 从硫酸亚铁铵溶液中获取硫酸亚铁铵晶体,可以用蒸发结晶,也可以用冷却结晶 | |
| C. | iPhone6外壳易掉色是因为铝壳表面氧化处理过程中作为阳极的金属铝纯度不够 | |
| D. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]溶液,观察铁钉周围出现蓝色沉淀的快慢 |
11.钴(Cu)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).

已知:部分金属离子形成氢氧化物沉淀的pH见下表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与Na2CO3反应的离子方程式是Co2O3+SO32-+4H+=Co2++SO42-+2H2O.
(3)步骤Ⅲ中若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+6H++5Cl-=3Cl2↑+3H2O,其中,Na2CO3溶液的作用是调节溶液PH使铁离子沉淀完全转化为Fe(OH)3.
(4)在空气中加热草酸钴晶体(CoC2O4•2H2O)样品需要用到的主要仪器是坩埚,5.49g该晶体受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210℃-290℃\;}}{\;}$Co3O4+6CO2.[M (CoC2O4•2H2O)=183 g/mol]
(5)从反应后的混合物中得到草酸钴晶体,需对晶体进行洗涤,证明晶体已经洗涤干净的操作及现象是取最后一次洗涤液于试管中,加入几滴稀硝酸酸化的硝酸银溶液,若无白色沉淀生成,说明已经洗净.

已知:部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al2+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与Na2CO3反应的离子方程式是Co2O3+SO32-+4H+=Co2++SO42-+2H2O.
(3)步骤Ⅲ中若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+6H++5Cl-=3Cl2↑+3H2O,其中,Na2CO3溶液的作用是调节溶液PH使铁离子沉淀完全转化为Fe(OH)3.
(4)在空气中加热草酸钴晶体(CoC2O4•2H2O)样品需要用到的主要仪器是坩埚,5.49g该晶体受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
(5)从反应后的混合物中得到草酸钴晶体,需对晶体进行洗涤,证明晶体已经洗涤干净的操作及现象是取最后一次洗涤液于试管中,加入几滴稀硝酸酸化的硝酸银溶液,若无白色沉淀生成,说明已经洗净.
8.对反应A+3B?2C来说,下列反应速率最快的是( )
| A. | v(A)=0.3 mol/(L•min) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v(A)=0.01 mol/(L•s) | D. | v(C)=0.5 mol/(L•min) |
7.在反应3H2+N2?2NH3中,经一段时间后,氨的浓度增加了0.6mol/L,在此时间内用H2表示的平均反应速率为0.45mol/(L•s),则反应所经历的时间为( )
| A. | 0.44 s | B. | 2 s | C. | 0.33 s | D. | 1 s |
5.请根据官能团的不同对下列有机物进行分类
①CH3CH2OH ②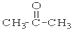 ③CH3CH2Br ④
③CH3CH2Br ④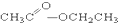 ⑤
⑤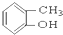 ⑥
⑥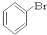 ⑦
⑦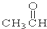 ⑧
⑧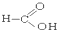 ⑨
⑨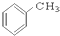 ⑩
⑩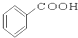
(1)芳香烃:⑨;(2)醇:①;
(3)醛:⑦;(4)酮:②;
(5)酚:⑤;(6)酯:④.
①CH3CH2OH ②
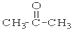 ③CH3CH2Br ④
③CH3CH2Br ④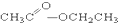 ⑤
⑤ ⑥
⑥ ⑦
⑦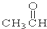 ⑧
⑧ ⑨
⑨ ⑩
⑩
(1)芳香烃:⑨;(2)醇:①;
(3)醛:⑦;(4)酮:②;
(5)酚:⑤;(6)酯:④.
4.下列物质常温下能与溴水发生取代反应的是( )
0 167958 167966 167972 167976 167982 167984 167988 167994 167996 168002 168008 168012 168014 168018 168024 168026 168032 168036 168038 168042 168044 168048 168050 168052 168053 168054 168056 168057 168058 168060 168062 168066 168068 168072 168074 168078 168084 168086 168092 168096 168098 168102 168108 168114 168116 168122 168126 168128 168134 168138 168144 168152 203614
| A. | 苯酚 | B. | 苯乙烯 | C. | 苯 | D. | 苯甲醇 |
 ;
; (1)拆开1mol H-H键,1mol N-H键,1mol N三N键分别需要吸收的能量为436kJ,391kJ,946kJ,则理论上,每生成1mol NH3放出(填:吸收或放出)热量46 kJ;
(1)拆开1mol H-H键,1mol N-H键,1mol N三N键分别需要吸收的能量为436kJ,391kJ,946kJ,则理论上,每生成1mol NH3放出(填:吸收或放出)热量46 kJ; ,可先向溶液中加入足量的银氨溶液加热,充分反应后,再加入足量的溴水.
,可先向溶液中加入足量的银氨溶液加热,充分反应后,再加入足量的溴水.