题目内容
13.化学实验在学科中有举足轻重的作用,结合下列实验的图示分析相关的描述正确的是( )| A. |  根据用电器(G)中指针的偏转方向可比较Zn、Cu的金属的氧化性 | |
| B. |  根据右侧小试管中液面的变化,可以判断铁钉发生了析氢腐蚀 | |
| C. |  测定中和热 | |
| D. |  根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断2NO2(g)?N2O4(g)是一个放热反应 |
分析 A.构成原电池,Zn为负极;
B.食盐水为中性,发生吸氧腐蚀;
C.图中没有保温瓶没有密封;
D.冰水中变浅,说明降低温度2NO2(g)?N2O4(g)正向移动.
解答 解:A.图中装置可构成原电池,Zn为负极,Cu为正极,则电器(G)中指针的偏向Cu,可知金属性Zn>Cu,金属不具有氧化性,故A错误;
B.图中食盐水为中性,发生吸氧腐蚀,而在酸性溶液中发生析氢腐蚀,故B错误;
C.图中没有保温瓶没有密封,应在上方盖上硬纸板,故D错误;
D.冰水中变浅,说明降低温度2NO2(g)?N2O4(g)正向移动,则2NO2(g)?N2O4(g)是一个放热反应,故D正确;
故选D..
点评 本题考查化学实验方案的评价,为高频考点,涉及原电池、化学腐蚀、中和热测定及平衡移动与反应热等,把握反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性及实验装置的分析,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
3. 某混合溶液中可能含有的离子如下表所示:
某混合溶液中可能含有的离子如下表所示:
为探究其成分,进行了以下探究实验.
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
①该溶液中一定不存在的阳离子是Mg2+、Fe3+、Ag+,一定不存在的阴离子是CO32-、AlO2-;含有的阳离子其对应物质的量浓度之比为H+、NH4+、Al3+为2:3:1;
②请写出沉淀减少过程中发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
①当起始至通入Cl2的体积为22.4L时,溶液中发生反应总的离子方程式为4Cl2+2Br-+6I-=8Cl-+Br2+3I2;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为1:2:1.
 某混合溶液中可能含有的离子如下表所示:
某混合溶液中可能含有的离子如下表所示:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
①该溶液中一定不存在的阳离子是Mg2+、Fe3+、Ag+,一定不存在的阴离子是CO32-、AlO2-;含有的阳离子其对应物质的量浓度之比为H+、NH4+、Al3+为2:3:1;
②请写出沉淀减少过程中发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 11.2L | 22.4L | 28.0L |
| n(Cl-) | 2.5mol | 3.5mol | 4.0mol |
| n(Br-) | 3.0mol | 2.5mol | 2.0mol |
| n(I-) | x mol | 0 | 0 |
②原溶液中Cl-、Br-、I-的物质的量浓度之比为1:2:1.
4.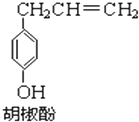 胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:
胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:
①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1mol该化合物最多可与2molBr2发生反应;
⑤该化合物可与NaOH和Na2CO3发生反应.其中正确的是( )
 胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:
胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1mol该化合物最多可与2molBr2发生反应;
⑤该化合物可与NaOH和Na2CO3发生反应.其中正确的是( )
| A. | ①③⑤ | B. | ①④⑤ | C. | ②③⑤ | D. | ③④⑤ |
1.四种短周期元素的离子aXm+、bYn+、cZn-、dRm-,它们具有相同的电子层结构,若m>n,对下列叙述正确的是( )
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y
⑤还原性Rm->Zn-
⑥X一定可与冷水反应.
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y
⑤还原性Rm->Zn-
⑥X一定可与冷水反应.
| A. | 只有②正确 | B. | ①②③④正确 | C. | ①②③⑥正确 | D. | ②③⑤正确 |
8.对反应A+3B?2C来说,下列反应速率最快的是( )
| A. | v(A)=0.3 mol/(L•min) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v(A)=0.01 mol/(L•s) | D. | v(C)=0.5 mol/(L•min) |
5.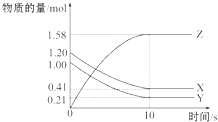 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )| A. | 从反应开始到10 s时,用Z表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 10s后,该反应停止进行 | |
| C. | 反应的化学方程式为2X(g)+Y(g)?2Z(g) | |
| D. | 从反应开始到10 s时,平均反应速率v(X)=v(Y)=0.039 5 mol•L-1•s-1 |
2.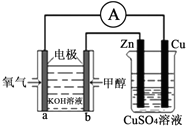 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.利用甲醇燃料电池设计如图所示的装置,则下列说法中不正确的是( )
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.利用甲醇燃料电池设计如图所示的装置,则下列说法中不正确的是( )
 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.利用甲醇燃料电池设计如图所示的装置,则下列说法中不正确的是( )
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.利用甲醇燃料电池设计如图所示的装置,则下列说法中不正确的是( )| A. | 该装置中Cu极为阳极 | |
| B. | 该装置中右池为电镀池,电解过程中CuSO4溶液pH不变 | |
| C. | b极的电极反应式为CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为1.12L |
3.运用元素周期律分析下列推断,其中错误的是( )
| A. | 铍是一种轻金属,它的氧化物的水化物可能具有两性 | |
| B. | 砹单质是一种有色固体,砹化氢很不稳定 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 硫酸锶难溶于水 |
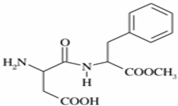 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.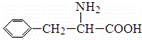 是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示: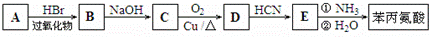
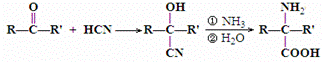
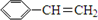

 .
.