题目内容
5.请根据官能团的不同对下列有机物进行分类①CH3CH2OH ②
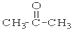 ③CH3CH2Br ④
③CH3CH2Br ④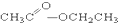 ⑤
⑤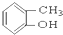 ⑥
⑥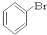 ⑦
⑦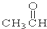 ⑧
⑧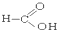 ⑨
⑨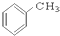 ⑩
⑩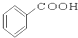
(1)芳香烃:⑨;(2)醇:①;
(3)醛:⑦;(4)酮:②;
(5)酚:⑤;(6)酯:④.
分析 (1)分子中只含有C和H两种元素,且含有苯环的有机物为芳香烃;
(2)羟基连在烃基上,不连在苯环上的属于醇;
(3)含有醛基属于醛类,醛基官能团为-CHO;
(4)含有酮基的为酮类,据此解答;
(5)羟基直接连在苯环上的属于酚羟基;
(6)含有酯基的属于酯类,酯类的官能团为-COOC-,据此解答即可.
解答 解:(1)分子中含有苯环的烃为芳香烃,故⑨符合,故答案为:⑨;
(2)醇是有机化合物的一大类,是脂肪烃、脂环烃或芳香烃侧链中的氢原子被羟基取代而成的化合物,故①符合,故答案为:①;
(3)醛是醛基(-CHO)和烃基(或氢原子)连接而成的化合物,故⑦符合,故答案为:⑦;
(4)酮是羰基与两个烃基相连的化合物,故②符合,故答案为:②;
(5)酚是羟基直接与苯环连接形成的化合物,故⑤符合,故答案为:⑤;
(6)酯是酸(羧酸或无机含氧酸)与醇起反应生成的一类有机化合物,故④符合,故答案为:④.
点评 本题考查了有机化合物的分类和结构特征,主要是理解各类物质的特征官能团和与官能团连接的取代基.

练习册系列答案
相关题目
15.(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):④→②→①→③.
(3)实验时可观察到装置①A瓶的溶液褪色,C瓶的溶液不褪色.试回答:A瓶溶液的作用是验证产物气流中有SO2,B瓶中反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
(4)装置②中所加的固体药品是无水硫酸铜,可验证的产物是水.
(5)装置③中所盛溶液是澄清石灰水,正确的现象是变浑浊.
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
(3)实验时可观察到装置①A瓶的溶液褪色,C瓶的溶液不褪色.试回答:A瓶溶液的作用是验证产物气流中有SO2,B瓶中反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
(4)装置②中所加的固体药品是无水硫酸铜,可验证的产物是水.
(5)装置③中所盛溶液是澄清石灰水,正确的现象是变浑浊.
16.元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素原子的外围电子排布为ns(n-1)np(n+1),
则下列说法不正确的是( )
| X | ||
| Y | ||
| Z |
| A. | Y元素原子的外围电子排布为4s24p4 | |
| B. | Y元素在周期表的第三周期第ⅥA族 | |
| C. | X元素所在周期中所含非金属元素最多 | |
| D. | Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
13.有关有机物分子结构或构型的判断,正确的是( )
| A. | 碳氢原子个数比为1:3的烃有两种 | |
| B. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 | |
| C. | 丙烷分子中的3个碳原子一定在同一平面上,丁烷分子中的4个碳原子不一定 | |
| D. | 常温下,液态烷中仅有一种一氯代物的只有新戊烷 |
20.在四个不同容器中,不同条件下进行合成氨反应.根据在相同时间内测定的结果判断生成氨的速率最快的是( )
| A. | v(N2)=0.1mol•L-1•s-1 | B. | v(H2)=0.1mol•L-1•min-1 | ||
| C. | v(NH3)=0.15mol•L-1•min-1 | D. | v(H2)=0.3mol•L-1•min-1 |
17.已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出F原子的电子排布式1s22s22p63s23p63d64s2,F位于周期表第VIII族.
(2)A、B、C的第一电离能由小到大的顺序为C<O<N.
(3)F和M(质子数为25)两元素的部分电离能数据列于如表:
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难.你的解释是Mn2+的3d轨道电子排布为半满状态较稳定.
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为8,一个晶胞中F原子的数目为2.
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因H2O2分子间存在氢键,与水分子可形成氢键.
(1)写出F原子的电子排布式1s22s22p63s23p63d64s2,F位于周期表第VIII族.
(2)A、B、C的第一电离能由小到大的顺序为C<O<N.
(3)F和M(质子数为25)两元素的部分电离能数据列于如表:
| 元 素 | M | F | |
| 电能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为8,一个晶胞中F原子的数目为2.
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
15.下列叙述错误的是( )
| A. | 工业上,乙苯主要通过苯与乙烯在合适条件下加成反应获得 | |
| B. | 实验室制得的溴苯含有多种有机杂质,除了苯之外,还可能含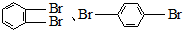 | |
| C. | 萘(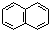 )不是苯的同系物,应属于联苯类芳香烃 )不是苯的同系物,应属于联苯类芳香烃 | |
| D. | D.甲苯与氯气在光照下反应生成的一氯代物主要为 |
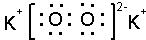 ;
; 某同学用如图装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究.回答下列问题:
某同学用如图装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究.回答下列问题: