7.pH相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是( )
| A. | 反应结束后溶液的pH:甲>乙 | |
| B. | 反应开始时的速率:甲>乙 | |
| C. | 反应所需时间:甲<乙 | |
| D. | 反应开始时,酸的物质的量浓度:甲>乙 |
6.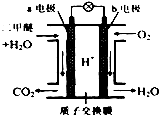 二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
 二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )| A. | a电极为该电池负极 | |
| B. | 电池工作时,燃料电池内部H+从a电极移向b电极 | |
| C. | 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O═2CO2↑+12H+ | |
| D. | O2在b电极上得电子,电极反应式:O2+4e-+2H2O═4OH- |
5.某温度下,某反应达到平衡,平衡常数k=C(CO2).C(H2)/C(CO).C(H2O).恒容时,升高温度,CO浓度增大.下列说法正确的是( )
| A. | 升高温度,逆反应速率增大,正反应速率减小 | |
| B. | 恒温时,增大压强,CO浓度不变 | |
| C. | 该反应的化学方程式为:CO2+H2?CO+H2O | |
| D. | 该反应的焓变为负值 |
4.在一定的温度下,向CH3COONa的稀溶液里加水稀释,下列各种量变小的是( )
①H+的物质的量浓度
②OH-的物质的量浓度
③c(CH3COO-)/c(CH3COOH)
④c(H+)•c(OH-)
①H+的物质的量浓度
②OH-的物质的量浓度
③c(CH3COO-)/c(CH3COOH)
④c(H+)•c(OH-)
| A. | ①② | B. | ② | C. | ②③ | D. | ②③④ |
3.下列有关金属腐蚀与防护的说法不正确的是( )
| A. | 钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-═4OH- | |
| B. | 当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
2.若溶液中由水电离产生的c(OH-)=1×10-14 mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | CH3COO- Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- AlO2- | D. | K+ I- SO42- NO3- |
1.下列说法不正确的是( )
0 167916 167924 167930 167934 167940 167942 167946 167952 167954 167960 167966 167970 167972 167976 167982 167984 167990 167994 167996 168000 168002 168006 168008 168010 168011 168012 168014 168015 168016 168018 168020 168024 168026 168030 168032 168036 168042 168044 168050 168054 168056 168060 168066 168072 168074 168080 168084 168086 168092 168096 168102 168110 203614
| A. | △H>0、△S>0的反应在任何温度下都不能自发进行 | |
| B. | 反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1之所以能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均不能单独作为反应自发性的判据 | |
| D. | 在其它外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
 ;若XY2为共价化合物时,其电子式为:
;若XY2为共价化合物时,其电子式为: .
.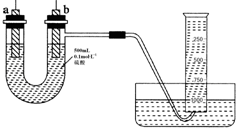 现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.
现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.