题目内容
18.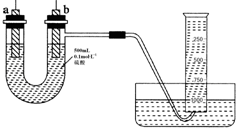 现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.
现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.(1)如图所示,装置气密性良好,且1 000mL量筒中已充满水,刚开始实验时,根据构成原电池必须满足的条件,首先要进行的操作是用导线把a、b两电极连接起来;
(2)a的电极材料为纯锌片,作原电池的负极;
电子经外电路由①(①a→b ②b→a 填序号,下同)
(3)b极上发生的电极反应为2H++2e-=H2↑,
反应时a极附近SO42-浓度逐渐减小.(填“逐渐增大”、“逐渐减小”或“始终不变”);
(4)假设反应过程中溶液体积不变,当硫酸浓度降低一半时,通过导线的电子的物质的量为0.05mol,量筒中收集的气体体积最接近CmL.(A.400 B.500 C.600 D.700)
分析 锌、铜、硫酸原电池中,电子转移和产生的氢气量之间存在联系;
(1)根据原电池装置的构成条件:闭合回路、电解质溶液、两个电极以及自发氧化还原反应来回答;
(2)活泼失电子的金属锌做负极,发生氧化反应,电子由负极流向正极;
(3)铜作正极,发生还原反应,根据硫酸根离子流向负极判断a极附近SO42-浓度;
(4)根据电极反应式进行计算即可.
解答 解:(1)根据图示装置,要想求得电子转移的量,需要设计成锌、铜、硫酸原电池,量取金属锌和硫酸反应产生氢气的体积,根据原电池的构成条件,所以首先要用导线把a、b两电极连接起来,
故答案为:用导线把a、b两电极连接起来;
(2)锌、铜、硫酸原电池中,纯锌片是负极,电子由负极流向正极,故答案为:纯锌片;负;①;
(3)铜是正极,该极上电极反应为:2H++2e-=H2↑,硫酸根离子流向负极,所以a极附近SO42-浓度逐渐减小,
故答案为:2H++2e-=H2↑;逐渐减小;
(4)正极上电极反应为:2H++2e-=H2↑,当硫酸浓度降低一半时即消耗氢离子为0.5×0.1×$\frac{1}{2}$×2=0.05moL,所以通过导线的电子的物质的量为0.05mol,标况下生成$\frac{0.05}{2}$=0.025mol氢气,标况下的体积为0.025×22.4=560ml,量筒中收集的气体体积最接近600ml,
故答案为:0.05 mol; C.
点评 本题以实验方式为载体考查学生原电池的构成条件和工作原理知识,注意基本知识的梳理是解题关键,难度中等.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | 原子核外电子排布决定了该原子的化学性质 | |
| B. | 根据原子序数可以推知该原子的中子数和其在周期表中的位置 | |
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca是具有相同质量数的同位素原子 | |
| D. | 所有的原子核都是由质子和中子组成的 |
13.某元素最高正价氧化物对应的水化物的化学式是HnXOm,该元素的气态氢化物的化学式为( )
| A. | HnX | B. | H(2m-n)X | C. | H(8+n-2m) X | D. | H(8+2m-n) X |
3.下列有关金属腐蚀与防护的说法不正确的是( )
| A. | 钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-═4OH- | |
| B. | 当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
10.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
| A. | 上述电解过程中共转移2 mol电子 | |
| B. | 原混合溶液中c(K+)为2 mol/L | |
| C. | 电解得到的Cu的物质的量为0.5 mol | |
| D. | 电解后溶液中c(H+)为2 mol/L |
7.2SO2(g)+O2(g)$?_{△}^{V_{2}O_{5}}$2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 一段时间内生成1 mol O2(g)同时生成1 mol SO3(g),说明反应达到平衡 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
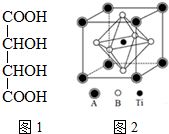 钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途.
钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途.