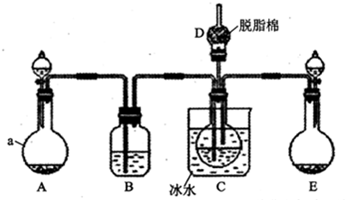
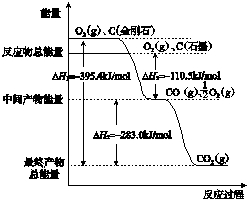
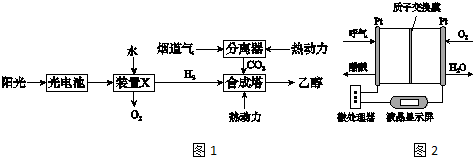
题目内容
5.某温度下,某反应达到平衡,平衡常数k=C(CO2).C(H2)/C(CO).C(H2O).恒容时,升高温度,CO浓度增大.下列说法正确的是( )| A. | 升高温度,逆反应速率增大,正反应速率减小 | |
| B. | 恒温时,增大压强,CO浓度不变 | |
| C. | 该反应的化学方程式为:CO2+H2?CO+H2O | |
| D. | 该反应的焓变为负值 |
分析 平衡常数指可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,平衡常数K是指可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,平衡常数K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$,所以该反应化学方程式应为CO+H2O?
CO2+H2,
A、温度升高,正逆反应都增大;
B、恒温恒容下,增大压强,分析引起压强增大的可能原因进行判断,如是加入稀有气体的话,各物质浓度没有变,所以平衡不移动,此时各物质的浓度不会变化.C、根据平衡常数表达式书写反应方程式;
D、恒容时,温度升高,CO浓度增大,平衡向逆反应移动,升高温度平衡向吸热反应移动;
解答 解:平衡常数k=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$,所以该反应化学方程式应为CO+H2O?CO2+H2.
A、温度升高,正逆反应速率都增大,故A错误;
B、恒温恒容下,增大压强,如果是加入稀有气体的话,各物质浓度没有变,所以平衡不移动,此时各物质的浓度不会变化,若增大水浓度,H2浓度一定减小,若增大CO2或氢气的浓度,CO浓度一定增大,故B错误;
C、平衡常数k=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$,所以该反应化学方程式应为CO+H2O?CO2+H2,故C错误;
D、恒容时,温度升高,CO浓度增大,平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,即该反应的焓变为负值,故D正确;
故选D.
点评 本题考查化学反应速率、化学平衡、平衡常数等,主要考查的内容为求算化学平衡常数和影响因素.注意①在化学平衡常数的公式中,反应物或生成物有固体或纯液体存在时,不代入公式中.②化学平衡常数只与温度有关,与反应物或生成物的浓度无关,题目难度中等.

| A. | HnX | B. | H(2m-n)X | C. | H(8+n-2m) X | D. | H(8+2m-n) X |
| A. | 上述电解过程中共转移2 mol电子 | |
| B. | 原混合溶液中c(K+)为2 mol/L | |
| C. | 电解得到的Cu的物质的量为0.5 mol | |
| D. | 电解后溶液中c(H+)为2 mol/L |
| A. | 卤代烃都可发生取代反应 | |
| B. | 由2-氯丙烷制取少量的1,2-丙二醇时,只需要经过取代反应、水解反应 | |
| C. | 实验室制硝基苯时,正确的操作顺序应该是先加入苯,再滴加浓硫酸,最后滴加浓硝酸 | |
| D. | 2-甲基-2-丁烯可以形成顺反异构 |
| A. | NH4Cl | B. | SO2 | C. | Cl2 | D. | Na2SO4 |