题目内容
1.下列说法不正确的是( )| A. | △H>0、△S>0的反应在任何温度下都不能自发进行 | |
| B. | 反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1之所以能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均不能单独作为反应自发性的判据 | |
| D. | 在其它外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
分析 A、根据△G=△H-T•△S<0来判断;
B、该反应为吸热反应,不能自发进行;而最终该反应能自发进行,则主要原因是体系有自发地向混乱度增加的方向转变的倾向;
C、反应自发与否决定于焓变和熵变两方面因素,依据反应自发进行的判断依据△H-T△S<0分析;
D、催化剂改变反应速率不改变化学平衡.
解答 解:A、反应的△H>0、△S>0,在高温下△G=△H-T•△S<0,能自发进行,故A错误;
B、该反应为吸热反应,不能自发进行;而最终该反应能自发进行,则主要原因是体系有自发地向混乱度增加的方向转变的倾向,故B正确;
C、依据反应自发进行的判断依据△H-T△S<0分析,反应自发进行需要焓变、熵变和温度共同决定,化学反应的焓变和熵变共同决定反应方向,故C正确;
D、催化剂改变反应速率不改变化学平衡,使用催化剂不可以改变化学反应进行的方向,故D正确;
故选A.
点评 本题考查了反应自发进行的分析判断,注意反应特征和焓变、熵变的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
11.某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4 ( 无明显现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全),对该混和气体的组成判断正确的是( )
| A. | 一定有H2、CO2和HCl | B. | 一定有CO、CO2和水蒸气 | ||
| C. | 一定没有CO2,肯定有H2 | D. | 可能有CO2、NH3和水蒸气 |
12.一定量的镁铝合金与375mL2mol/L的HNO3完全反应生成3.36LNO(标准状态)和镁盐、铝盐等,再向反应后的溶液中加入3mol/LNaOH溶液,使镁、铝元素完全沉淀下来,则所加入氢氧化钠溶液的体积是( )
| A. | 150mL | B. | 200mL | C. | 450mL | D. | 无法计算 |
9.对下列化学反应的热现象的说法正确的是( )
| A. | 所有的放热反应不加热都能进行 | |
| B. | 任何化学反应的发生一定伴有能量变化 | |
| C. | 吸热反应和放热反应都需要加热才能发生 | |
| D. | 化学反应吸收或放出热量的多少与参加反应的物质的多少无关 |
16.某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是( )
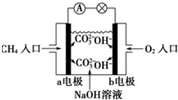

| A. | a极是负极,发生氧化反应 | |
| B. | 正极的电极反应是:O2+2H2O+4e-=4OH- | |
| C. | 该甲烷燃料电池的总反应:CH4+2O2=CO2+2H2O | |
| D. | 甲烷燃料电池是环保电池 |
6.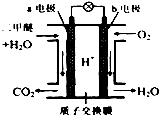 二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
 二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )| A. | a电极为该电池负极 | |
| B. | 电池工作时,燃料电池内部H+从a电极移向b电极 | |
| C. | 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O═2CO2↑+12H+ | |
| D. | O2在b电极上得电子,电极反应式:O2+4e-+2H2O═4OH- |
13.氨分子空间构型是三角锥形,键角小于109°28′,而甲烷是正四面体,键角等于109°28′,键角差别是因为( )
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 | |
| B. | NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤电子对,它对成键电子对的排斥作用较强 | |
| D. | 氨气分子是极性分子而甲烷是非极性分子 |
3.已知3.0g乙烷完全燃烧在常温下放出的热量为155.98kJ,则下列表示乙烷燃烧热的热化学方程式书写正确的是( )
| A. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-2119.6kJ/mol | |
| B. | C2H6(g)+$\frac{5}{2}$O2(g)═2CO(g)+3H2O(g)△H=-1559.8kJ/mol | |
| C. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(g)△H=-1559.8kJ/mol | |
| D. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1559.8kJ/mol |