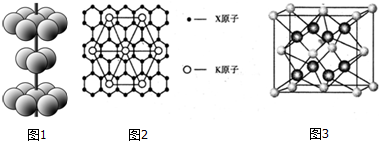
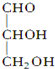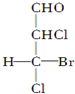6.下列实验操作、现象、和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盐酸中加入浓硫酸 | 产生白雾 | 浓硫酸有吸水性 |
| B | 向某红色溶液中通入SO2气体 | 红色褪去 | SO2具有漂白性 |
| C | 将乙醇与浓硫酸共热产生的气体通入酸性高锰酸钾溶液中 | 紫红色变浅 | 反应生成乙烯 |
| D | 向碳酸钠溶液中滴加几滴酚酞后,加热 | 红色加深 | 盐类水解是吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
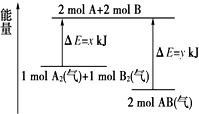
4.反应A2(气)+B2(气)═2AB(气)的能量变化如图所示,下列说法正确的是( )
0 167908 167916 167922 167926 167932 167934 167938 167944 167946 167952 167958 167962 167964 167968 167974 167976 167982 167986 167988 167992 167994 167998 168000 168002 168003 168004 168006 168007 168008 168010 168012 168016 168018 168022 168024 168028 168034 168036 168042 168046 168048 168052 168058 168064 168066 168072 168076 168078 168084 168088 168094 168102 203614

| A. | 该反应是吸收能量的反应 | |
| B. | 断开1 mol A2(气)和1 mol B2(气)中的化学键共放出x kJ热量 | |
| C. | 2 mol AB(气)中的化学键断裂要吸收y kJ热量 | |
| D. | 2 mol AB(气)的总能量大于1 mol A2(气)和1 molB2(气)的总能量 |
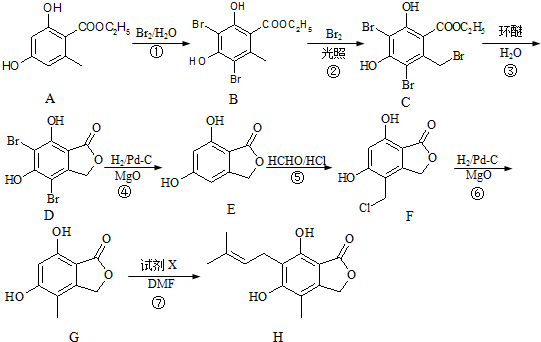
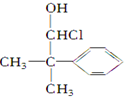
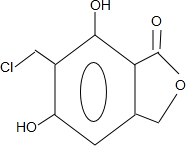 (任写一种).
(任写一种).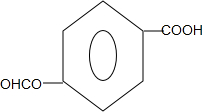 .
.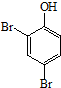 、HCHO为原料制备
、HCHO为原料制备 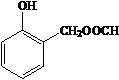 合成路线流程图(无机试剂任用).合成路线流程图示例如下:
合成路线流程图(无机试剂任用).合成路线流程图示例如下: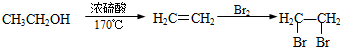
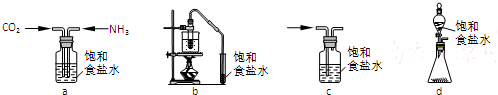
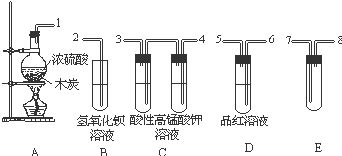 浓H2SO4与炭反应,产物成分可用如图装置来确认:
浓H2SO4与炭反应,产物成分可用如图装置来确认: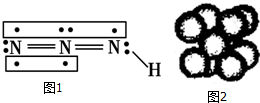 叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.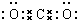 .
.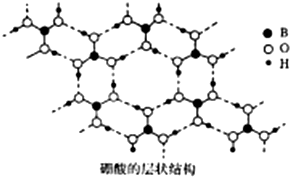 硼(B)及其化合物在化学中有重要的地位.请回答下列问题:
硼(B)及其化合物在化学中有重要的地位.请回答下列问题: [B(OH)4]-+H+.
[B(OH)4]-+H+.