题目内容
1.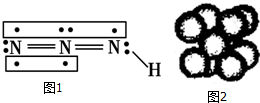 叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.试回答下列问题:
(1)下列说法正确的是CD(选填序号).
A.酸性:HNO2>HNO3
B.N2H4中两个氮原子采用的都是sp2杂化
C.HN3、H2O都是极性分子
D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮化物能与Fe3+、Cu2+及Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显+3价,根据价层电子对互斥理论可知SO42-的立体构型为正四面体形,基态Fe原子有4个未成对电子,可用硫氰化钾检验Fe3+,形成的配合物的颜色为血红色.
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)═2Na(l)+3N2(g),下列说法正确的是BC(选填序号).
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如图2,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮元素的电负性小
(4)与N3-互为等电子体的分子有:CO2、BeCl2(举二例),写出其中之一的电子式
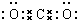 .
.
分析 (1)A、HNO2为弱酸,而HNO3是强酸;
B、N2H4中氮原子最外层有5个电子,形成三对共用电子对,另外还有一对孤电子对,氮原子采用的都是sp3杂化;
C、HN3、H2O中都有孤电子对,所以都是极性分子;
D、氢键主要存在于N、F、O三种元素的氢化物分子之间,可使物质的熔沸点变大,N2H4沸点高达113.5℃,可以说明肼分子间可形成氢键.
(2)在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,可以算得钴的化合价,SO2-4中S原子采用sp3杂化方式,可知SO2-4的立体构型为正四面体,根据Fe原子的核外电子排布式确定未成对电子数,失去电子变为铁离子时,先失去4s上的电子后失去3d上的电子,硫氰化铁为血红色;
(3)A、NaN3与KN3结构类似,Na+半径小于K+,所以NaN3的晶格能比KN3大;
B、钠晶胞中,在8个顶点上各有一个原子,体心上还有一个,所以晶胞中钠原子的个数为:8×$\frac{1}{8}$+1=2;
C、氮原子的最外层P轨道有3个电子,处于半充满状态,是一种较稳定结构,所以它的第一电离能大于氧;
D、氮气常温下很稳定,是因为氮气是双原子分子,两个氮原子之间存在N≡N键,不易断裂,与元素的电负性无关.
(4)在N-3中,价电子数为16,根据等电子体原理,可以写出等电子体的分子;根据共价化合物的电子式书写方法分析.
解答 解:(1)A、HNO2为弱酸,而HNO3是强酸,故A错误;
B、N2H4中氮原子最外层有5个电子,形成三对共用电子对,另外还有一对孤电子对,氮原子采用的都是sp3杂化,故B错误;
C、HN3、H2O中都有孤电子对,所以都是极性分子,故C正确;
D、氢键主要存在于N、F、O三种元素的氢化物分子之间,可使物质的熔沸点变大,N2H4沸点高达113.5℃,可以说明肼分子间可形成氢键,故D正确.
故答案为:CD;
(2)在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,可以算得钴的化合价为:+3价,SO2-4中S原子采用sp3杂化方式,可知SO2-4的立体构型为正四面体;26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,硫氰化铁为血红色;.
故答案为:+3;正四面体;4;血红色;
(3)A、NaN3与KN3结构类似,Na+半径小于K+,所以NaN3的晶格能比KN3大,故A错误;
B、钠晶胞中,在8个顶点上各有一个原子,体心上还有一个,所以晶胞中钠原子的个数为:8×$\frac{1}{8}$+1=2,故B正确;
C、子的最外层P轨道有3个电子,处于半充满状态,是一种较稳定结构,所以它的第一电离能大于氧,故C正确;
D、常温下很稳定,是因为氮气是双原子分子,两个氮原子之间存在N≡N键,不易断裂,与元素的电负性无关,故D错误.
故答案为B:C;
(4)在N-3中,价电子数为16,根据等电子体原理,可以写出与N-3互为电子体的分子为CO2、BeCl2等,二氧化碳为共价化合物,其电子式为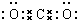 .
.
故答案为:CO2;BeCl2; 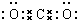 .
.
点评 本题考查了学生对原子的杂化方式、分子的空间结构、等电子体、电子式等,具有一定的综合性,对学生综合能力有一定的要求.中等难度.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案| A. | 氧化剂 | B. | 还原剂 | C. | 催化剂 | D. | 反应物 |
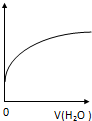
| A. | CH3COO-水解常数 | B. | 溶液中CH3COOH的数目 | ||
| C. | 溶液的PH | D. | 溶液中CH3COO- 的浓度 |
| A. | X与Y形成化合物时,X可能显负价,也可能显正价 | |
| B. | 第一电离能X可能小于Y | |
| C. | X的最高价含氧酸的酸性强于Y的最高价含氧酸的酸性 | |
| D. | 原子序数X一定大于Y |
| A. | 在周期表中,氯元素位于硫元素之后,所以Cl2的氧化性弱于硫单质 | |
| B. | 硫黄中只有非极性键,S2Cl2中只有极性键 | |
| C. | 在常温常压下,硫黄是原子晶体,S2Cl2是分子晶体 | |
| D. | S2Cl2与水反应时,既体现氧化性又体现还原性 |
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盐酸中加入浓硫酸 | 产生白雾 | 浓硫酸有吸水性 |
| B | 向某红色溶液中通入SO2气体 | 红色褪去 | SO2具有漂白性 |
| C | 将乙醇与浓硫酸共热产生的气体通入酸性高锰酸钾溶液中 | 紫红色变浅 | 反应生成乙烯 |
| D | 向碳酸钠溶液中滴加几滴酚酞后,加热 | 红色加深 | 盐类水解是吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 该反应中电子转移数为6 | B. | 生成的氯气式量约为73.3 | ||
| C. | KCl中既有35Cl,又有37Cl | D. | KCl中只含35Cl |
| A. | 原电池中电解质溶液能电离出自由移动的离子 | |
| B. | 有两根导线将两个活动性不同的电极连接 | |
| C. | 电极上进行的氧化还原反应的生成物为电子 | |
| D. | 电极上进行氧化还原反应时有电子的定向移动 |
