题目内容
5.氯化钠是氯碱工业的主要原料,其晶体不带有结晶水,饱和食盐水也是实验室常用试剂.完成下列填空:(1)粗盐中含有Ca2+、Mg2+、SO42-等离子和少量泥沙,某同学设计的提纯步骤依次为:溶解、过滤、加入沉淀剂、调pH、蒸发结晶.其中还缺少的步骤是过滤.
(2)电解饱和食盐水实验中,检验阳极产物的试剂是湿润的淀粉KI试纸;若用粗盐配制饱和食盐水进行电解,则阴极区可能出现的异常现象是出现浑浊现象.
(3)氯碱厂称固体烧碱为“片碱”.用滴定法测定片碱中杂质Na2CO3含量的过程如下:称取样品,加水溶解;加入酚酞试液,用标准盐酸滴定至溶液由红色刚好变为无色;再加甲基橙,继续用标准盐酸滴定至终点.数据处理.实验中用于溶解片碱的蒸馏水必须事先煮沸一段时间,煮沸的目的是除去可能溶解的CO2,防止对测定结果产生干扰;用甲基橙作指示剂时,判断滴定达到终点的现象是溶液由黄色变为橙色,且半分钟不变;用酚酞作指示剂时,发生反应的离子方程式为H++OH-=H2O、CO32-+H+=HCO3-.
(4)下列关于饱和食盐水的用途及装置设计正确的是cd.(填写编号)
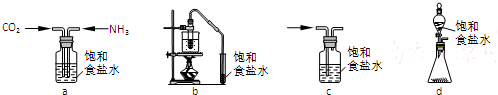
a.模拟工业制纯碱b.制乙酸乙酯实验中接受产物c.除去氯气中的氯化氢d.实验室制乙炔
(5)在饱和食盐水中加入浓硫酸,会有大量固体析出.过滤、洗涤、得干燥固体.为确定该固体的成份,进行以下实验:①取少量固体溶于水,测得溶液显中性;②称取1.961g固体于坩埚中加热,发现有水生成,继续加热至固体恒重,称量质量为1.331g.判断固体已恒重的操作是连续两次加热、冷却、称量,质量差不超过0.001g;③将1.331g固体全部溶于水,加入足量的BaCl2溶液,得干燥纯净沉淀1.165g.则原固体的成份是Na2SO4•7H2O、NaCl.(写化学式)
分析 (1)首先溶解粗盐,然后选用碳酸钠溶液除去钙离子、除去镁离子、铁离子选用氢氧化钠溶液、除去硫酸根离子选用氯化钡溶液,为了保证将杂质除尽,所加试剂必须过量,为了不引进新的杂质,应该先加入氢氧化钠,然后加入氯化钡,再加入碳酸钠,过滤后的溶液调节溶液PH,最后加热盐酸;加入的每种试剂必须过量,保证将所有杂质都能除去,反应完采用加热方法,除去剩余的氯化氢;
(2)电解饱和食盐水阳极是溶液中氯离子失电子生成氯气,可以利用氯气的氧化性用湿润的淀粉碘化钾试纸检验生成的氯气,若用粗盐配制饱和食盐水进行电解,阴极氢离子得到电子生成氢气,溶液中氢氧根离子浓度增大,会结合镁了形成氢氧化镁沉淀;
(3)滴定实验过程中蒸馏水中的二氧化碳气体会干扰测定结果,甲基橙的变色范围是3.1-4.4,酸滴碱终点溶液颜色变化为黄色变化为橙色,酚酞指示剂变色范围为8-10,酸滴定碱在碱性环境下变色指示终点,碳酸钠生成碳酸氢钠;
(4)a、工业制碱是利用向氨化的饱和食盐水中通入二氧化碳生成碳酸氢钠得到晶体,受热生成碳酸钠,二氧化碳溶解性小为充分吸收二氧化碳,氨气是极易溶于水的气体,导气管应紧靠在液面上,防止倒吸;
b、乙酸乙酯需要直接加热生成,在饱和碳酸钠溶液中除去乙醇、乙酸,降低酯的溶解度分层,饱和氯化钠溶液无此作用;
c、氯气中的氯化氢可以通过饱和食盐水除去,氯离子浓度增大,抑制氯气和水的反应;
d、实验室制备乙炔为减缓反应速率可以用饱和食盐水代替水与电石发生反应;
(5)取少量固体溶于水,测得溶液显中性,坩埚中加热,发现有水生成说明操作结晶水合物,结晶水质量=1.961g-1.331g=0.63g,物质的量=$\frac{0.63g}{18g/mol}$=0.035mol判断固体已恒重的操作,是连续两次加热、冷却、称量,质量差不超过0.001g,说明固体分解完全,质量恒重,将1.331g固体全部溶于水,加入足量的BaCl2溶液,得干燥纯净沉淀为BaSO4质量1.165g,物质的量=$\frac{1.165g}{233g/mol}$=0.005mol,结晶水合物只能为硫酸钠晶体,所以1mol晶体中含有结晶水为7,化学式为:Na2SO4•7H2O,依据质量守恒计算判断1.331g中含有氯化钠.
解答 解:(1)粗盐溶解,然后先加入足量的NaOH,除去镁离子、铁离子;然后加入过量BaCl2,除去SO42-、CO32-;再加入过量Na2CO3 除去Ca2+和过量的Ba2+;过滤后,滤液中加入过量的盐酸,除去溶液中剩余的碳酸根和氢氧化钠中的氢氧根,最后加热除去剩余的氯化氢,故答案为:过滤;
(2)电解饱和食盐水阳极是溶液中氯离子失电子生成氯气,可以利用氯气的氧化性,用湿润的淀粉碘化钾试纸检验生成的氯气,若用粗盐配制饱和食盐水进行电解,阴极氢离子得到电子生成氢气,溶液中氢氧根离子浓度增大,会结合镁了形成氢氧化镁沉淀,阴极区可能出现的异常现象是,出现浑浊现象,
故答案为:湿润的淀粉KI试纸;出现浑浊现象;
(3)滴定实验过程中蒸馏水中的二氧化碳气体会干扰测定结果,实验中用于溶解片碱的蒸馏水必须事先煮沸一段时间,煮沸的目的是除去可能溶解的CO2,防止对测定结果产生干扰;甲基橙的变色范围是3.1-4.4,酸滴碱终点溶液颜色变化为黄色变化为橙色,且半分钟不变,说明反应达到终点,酚酞指示剂变色范围为8-10,酸滴定碱在碱性环境下变色指示终点,碳酸钠生成碳酸氢钠,反应的离子方程式为:H++OH-=H2O、CO32-+H+=HCO3-,
故答案为:除去可能溶解的CO2,防止对测定结果产生干扰;溶液由黄色变为橙色,且半分钟不变;H++OH-=H2O、CO32-+H+=HCO3-;
(4)a、工业制碱是利用向氨化的饱和食盐水中通入二氧化碳生成碳酸氢钠得到晶体,受热生成碳酸钠,二氧化碳溶解性小为充分吸收二氧化碳,氨气是极易溶于水的气体,导气管应紧靠在液面上,防止倒吸,脂质体中导气管位置错误,故a错误;
b、乙酸乙酯需要直接加热生成,在饱和碳酸钠溶液中除去乙醇、乙酸,降低酯的溶解度分层,饱和氯化钠溶液无此作用,故b错误;
c、氯气中的氯化氢可以通过饱和食盐水除去,氯离子浓度增大,抑制氯气和水的反应,减少氯气的溶解,同时除去极易溶于水的氯化氢,故c正确;
d、实验室制备乙炔,水和电石反应剧烈,易产生大量泡沫沿导管喷出,为减缓反应速率可以用饱和食盐水代替水与电石发生反应,故d正确;
故答案为:cd;
(5)取少量固体溶于水,测得溶液显中性,坩埚中加热,发现有水生成说明操作结晶水合物,结晶水质量=1.961g-1.331g=0.63g,物质的量=$\frac{0.63g}{18g/mol}$=0.035mol判断固体已恒重的操作,是连续两次加热、冷却、称量,质量差不超过0.001g,说明固体分解完全,质量恒重,将1.331g固体全部溶于水,加入足量的BaCl2溶液,得干燥纯净沉淀为BaSO4质量1.165g,物质的量=$\frac{1.165g}{233g/mol}$=0.005mol,结晶水合物只能为硫酸钠晶体,所以1mol晶体中含有结晶水为7,化学式为:Na2SO4•7H2O,依据质量守恒计算,1.331g固体中硫酸钠晶体质量=0.005mol×142g/mol=0.71g,所以应含有NaCl,质量为1.331g-0.71g=0.621g,
故答案为:连续两次加热、冷却、称量,质量差不超过0.001g;Na2SO4•7H2O、NaCl.
点评 本题考查了物质组成实验探究方法和实验过程分析判断,主要是物质性质和实验基本操作的理解应用,掌握基础是关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 氧化铝是一种高硬度、高熔沸点的化合物 | |
| B. | 铝是活泼的金属,其合金抗腐蚀能力差 | |
| C. | 铝合金具有密度小、高强度及较好的可塑性 | |
| D. | 铝合金可用于制飞机骨架等 |
| A. | 丙烯分子中3个碳原子都是sp3杂化 | |
| B. | 丙烯分子存在非极性键 | |
| C. | 丙烯分子有6个σ键,1个π键 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| C. | PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | 开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题 |
| A. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热--检验混合物中是否含有甲醛 | |
| B. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| C. | 苯不能与溴水发生取代反应,用苯能萃取溴的四氯化碳溶液中的溴 | |
| D. | 利用核磁共振氢谱,可以鉴别CH3OCH3和CH3CH2OH |
 .
.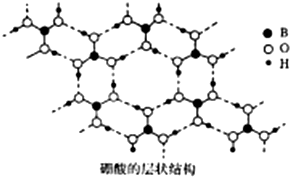 硼(B)及其化合物在化学中有重要的地位.请回答下列问题:
硼(B)及其化合物在化学中有重要的地位.请回答下列问题: [B(OH)4]-+H+.
[B(OH)4]-+H+.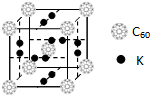 碳元素是构成物质种类最多的一种元素,许多物质与我们的生活息息相关.
碳元素是构成物质种类最多的一种元素,许多物质与我们的生活息息相关. ,该物质的K原子和C60分子的个数比为3:1.
,该物质的K原子和C60分子的个数比为3:1.