题目内容
19.X、Y、Z、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子已全充满,最外层只有2个电子.请回答:(1)X元素在周期表中的位置是第二周期ⅣA族;W2+离子的外围电子排布式为3d10
(2)X 能与氢、氮、氧三种元素构成化合物 XO(NH2)2,其中X原子和N原子的杂化方式为分别为sp2、sp3,该化合物分子中的π键与σ键的个数之比是1:7;该物质易溶于水的主要原因是CO(NH2)2能与水分子间形成氢键.
(3)已知Be和Al元素处于周期表中对角线位置,化学性质相似,请写出Y元素与Be的最高价氧化物的水化物相互反应的化学方程式Be(OH)2+2NaOH═Na2BeO2+2H2O
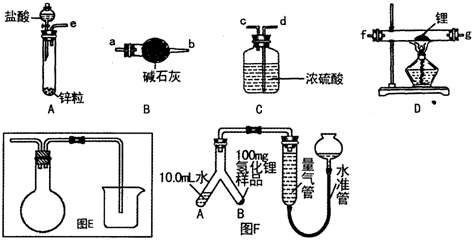
(4)M晶体的原子堆积方式为六方堆积(如图1所示),则晶体中M原子配位数是12.某M配合物化学式是[M(H2O)5Cl]Cl2•H2O,1mol该配合物中含配位键的数目是6×6.02×1023.
(5)X 的某种晶体为层状结构,可与熔融金属钾作用.钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图2所示,则其化学式可表示为KC8.
(6)Y离子和Z离子比较,半径较大的是S2-(写离子符号),元素Y与元素Z形成的晶体的晶胞结构是如图3所示的正方体,设晶胞中最近的两个Z离子的距离为a cm,该化合物的摩尔质量为bg/mol,则该晶胞密度的计算式为4×$\frac{bg/mol}{{N}_{A}mo{l}^{-1}}$÷($\sqrt{2}$a cm)3.(只要求列算式,不必计算出数值,阿伏伽德罗常数用NA表示).
分析 X、Y、Z、W是元素周期表前四周期中常见的元素,X的基态原子核外的三个能级上电子数相等,原子核外电子排布为1s22s22p2,则X为C元素;Y的单质在空气中燃烧生成一种淡黄色的固体,则Y为Na元素,淡黄色固体是Na2O2;Z元素原子的最外层电子数比次外层电子数少2个,原子只能有3个电子层,最外层电子数为6,故Z为S元素;M原子外围电子排布式为3dn4sn,由于4s能级最大容纳2个电子,且3d能级容纳电子,故n=2,则M为Ti;W的内层电子已全充满,最外层只有2个电子,原子序数大于硫,只能处于第四周期,原子核外电子数为2+8+18+2=30,故W为Zn,据此解答.
解答 解:X、Y、Z、W是元素周期表前四周期中常见的元素,X的基态原子核外的三个能级上电子数相等,原子核外电子排布为1s22s22p2,则X为C元素;Y的单质在空气中燃烧生成一种淡黄色的固体,则Y为Na元素,淡黄色固体是Na2O2;Z元素原子的最外层电子数比次外层电子数少2个,原子只能有3个电子层,最外层电子数为6,故Z为S元素;M原子外围电子排布式为3dn4sn,由于4s能级最大容纳2个电子,且3d能级容纳电子,故n=2,则M为Ti;W的内层电子已全充满,最外层只有2个电子,原子序数大于硫,只能处于第四周期,原子核外电子数为2+8+18+2=30,故W为Zn.
(1)X为C元素,C原子核外有2个电子层、最外层有4个电子,所以处于周期表中第二周期ⅣA族,Zn2+离子的外围电子排布式为3d10,
故答案为:第二周期ⅣA族;3d10;
(2)碳能与氢、氮、氧三种元素构成化合物 CO(NH2)2,分子中C与O形成C=O双键,C原子与N原子形成C-N单键,N原子与H原子之间形成N-H单键,分子中C原子成3个σ键,没有孤电子对,故C原子采取sp2杂化,N原子成3个σ键、有1对孤电子对,故N原子采取sp3杂化,该化合物分子中有1个π键、7个σ键,π键与σ键数目之比为1:7,CO(NH2)2能与水分子间形成氢键,该物质易溶于水,
故答案为:sp2;sp3;CO(NH2)2能与水分子间形成氢键;
(3)Be和Al元素处于周期表中对角线位置,化学性质相似,则Be(OH)2与NaOH反应生成Na2BeO2与H2O,故反应方程式为:Be(OH)2+2NaOH═Na2BeO2+2H2O,
故答案为:Be(OH)2+2NaOH═Na2BeO2+2H2O;
(4)M晶体的原子堆积方式为图1所示,为六方密堆积,以轴线原子研究,层内有6个原子相邻、上、下两层各有3个原子与之相邻,故配位数为12,某M配合物化学式是[M(H2O)5Cl]Cl2•H2O,M离子与H2O、Cl-形成配位键,1mol该配合物中含配位键为6mol,含有配位键的数目是6×6.02×1023,
故答案为:12;6×6.02×1023;
(5)可以取三个钾原子形成的小三角形为计算单位,其完全占有的碳原子数是4,占有的钾原子数为$\frac{1}{6}$×3=$\frac{1}{2}$,故碳原子数和钾原子数之比是4:$\frac{1}{2}$=8:1,X的某种晶则其化学式时表示为KC8,
故答案为:KC8;
(6)S2-离子比Na+离子多一个电子层,故离子半径:S2->Na+;
晶胞中黑色球数目为8,白色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故化学式为Na2S,黑色球为Na+、白色球为S2-,晶胞质量为4×$\frac{bg/mol}{{N}_{A}mo{l}^{-1}}$,设晶胞中最近的两个S2-离子的距离为a cm,面对角线上的3个S2-离子中相邻个离子之间距离最近,晶胞棱长为2a cm×$\frac{\sqrt{2}}{2}$=$\sqrt{2}$a cm,故晶胞密度为4×$\frac{bg/mol}{{N}_{A}mo{l}^{-1}}$÷($\sqrt{2}$a cm)3,
故答案为:S2-;4×$\frac{bg/mol}{{N}_{A}mo{l}^{-1}}$÷($\sqrt{2}$a cm)3.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化方式、氢键、配合物、晶胞结构及计算,侧重对晶胞计算的考查,对学生的空间想象与数学计算有一定的要求,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | Fe3+、K+、Na+、SO42- | B. | Na+、K+、CO32-、Cl- | ||
| C. | Mg2+、Na+、Cl-、NO3- | D. | Ba2+、K+、ClO-、SO42- |
| A. | NCl3分子中N-Cl键的键长比CCl4分子中C-Cl键的键长长 | |
| B. | NCl3分子是非极性分子 | |
| C. | 分子中的所有原子均达到8电子稳定结构 | |
| D. | NCl3不含孤电子对 |
| A. | 具有规则几何外形的固体均为晶体 | |
| B. | 晶体具有自范性,有固定的熔点,可以使X光发生有规律的衍射 | |
| C. | 晶体研碎后即变为非晶体 | |
| D. | 将玻璃加工成规则的固体即变成晶体 |
| A. | BCl3、CS2、SO3 | B. | CH4、CH2Cl2、BeCl2 | ||
| C. | P4、SiO2、CO2 | D. | NF3、CCl4、苯(C6H6) |
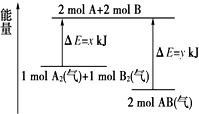
| A. | 该反应是吸收能量的反应 | |
| B. | 断开1 mol A2(气)和1 mol B2(气)中的化学键共放出x kJ热量 | |
| C. | 2 mol AB(气)中的化学键断裂要吸收y kJ热量 | |
| D. | 2 mol AB(气)的总能量大于1 mol A2(气)和1 molB2(气)的总能量 |
| A. | 一定有H2、CO2和HCl | B. | 一定有CO、CO2和水蒸气 | ||
| C. | 一定没有CO2,肯定有H2 | D. | 可能有CO2、NH3和水蒸气 |
| A. | 所有的放热反应不加热都能进行 | |
| B. | 任何化学反应的发生一定伴有能量变化 | |
| C. | 吸热反应和放热反应都需要加热才能发生 | |
| D. | 化学反应吸收或放出热量的多少与参加反应的物质的多少无关 |