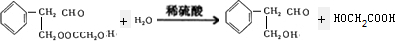
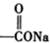题目内容
4.反应A2(气)+B2(气)═2AB(气)的能量变化如图所示,下列说法正确的是( )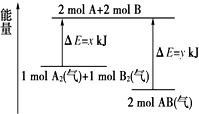
| A. | 该反应是吸收能量的反应 | |
| B. | 断开1 mol A2(气)和1 mol B2(气)中的化学键共放出x kJ热量 | |
| C. | 2 mol AB(气)中的化学键断裂要吸收y kJ热量 | |
| D. | 2 mol AB(气)的总能量大于1 mol A2(气)和1 molB2(气)的总能量 |
分析 A、根据反应物的能量高于生成物的能量时,反应是放热反应;
B、根据旧键的断裂吸收能量,新键的形成释放能量;
C、根据旧键的断裂吸收能量,新键的形成释放能量;
D、根据图象可判断反应物与生成物的总能量.
解答 解:A、因反应物的能量高于生成物的能量时,反应是放热反应,故A错误;
B、因旧键的断裂吸收能量,而不是释放能量,故B错误;
C、因旧键的断裂吸收能量,由图可知断裂2molA-B键需要吸收ykJ能量,故C正确;
D、由图可知,1molA2和1molB2的总能量高于2molAB的总能量,故D错误;
故选C.
点评 本题考查学生有关化学反应中的能量变化知识,可以根据所学知识来进行,难度不大.

练习册系列答案
相关题目
12.下列说法中正确的是( )
| A. | 乙烯中C=C的键能是乙烷中C-C的键能的2倍 | |
| B. | 同一原子中,2p,3p,4p能级的轨道数目依次增多 | |
| C. | C-O键的极性比N-O键的极性大 | |
| D. | 根据能量最低原理,原子的核外电子排布先填满离核近的轨道,再填充离核远的轨道 |
9.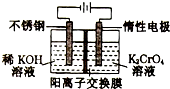 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )
 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )| A. | 在阳极室,通电后溶液逐渐由黄色变为橙色 | |
| B. | 在阴极室,发生的电极反应为:2H2O+2e-═2OH-+H2↑ | |
| C. | 若测得右室中K与Cr的物质的量之比($\frac{nk}{ncr}$)为3:2,则此过程电路中共转移电子数为0.1NA | |
| D. | 若测定阳极液中K与Cr的物质的量之比($\frac{nk}{ncr}$)为d,则此时铬酸钾的转化率为2-d |
13. 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
①分子式为C10H9O3
②1mol该有机物能与溴水中3mol溴发生取代反应
③该物质含有3种官能团
④能使酸性KMnO4溶液褪色.
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )①分子式为C10H9O3
②1mol该有机物能与溴水中3mol溴发生取代反应
③该物质含有3种官能团
④能使酸性KMnO4溶液褪色.
| A. | ③④ | B. | ①④ | C. | ②③④ | D. | ①②③④ |
14.观察分析,符合图中变化的化学反应为( )


| A. | A2+3B2═2AB3 | B. | 2AB2+B2═2AB3 | C. | 2A2B+5B2=4AB3 | D. | 2AB2+B2=2AB3 |
 .
. 的系统命名法的名称为2,2,5,5-四甲基庚烷.
的系统命名法的名称为2,2,5,5-四甲基庚烷.

 $\stackrel{稀氢氧化钠溶液}{→}$
$\stackrel{稀氢氧化钠溶液}{→}$ -CHO+
-CHO+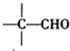 +NaOH(浓)→
+NaOH(浓)→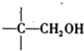 +
+