16.有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体为( )
| A. | 2.24L | B. | 1.12L | C. | 0.672L | D. | 0.448L |
15.有关说法中正确的是( )
| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | P4和CH4都是正四面体型结构的分子,且键角都为109°28ˊ | |
| C. | 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 | |
| D. | 电子层结构相同的简单离子,其半径随核电荷数增大而减小 |
14.下列说法中,不正确的是( )
①同一元素的不同核素互称为同位素
②两个非金属元素原子间不可能形成离子键
③金属腐蚀的实质是金属原子失去电子被还原的过程
④因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
⑤元素的非金属性越强,其氧化物对应的水化物的酸性就越强
⑥青铜、不锈钢、硬铝都是合金
⑦Al和Fe在一定条件下都能与某些氧化物反应
⑧化学键可以使离子相结合,也可以使原子相结合.
①同一元素的不同核素互称为同位素
②两个非金属元素原子间不可能形成离子键
③金属腐蚀的实质是金属原子失去电子被还原的过程
④因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
⑤元素的非金属性越强,其氧化物对应的水化物的酸性就越强
⑥青铜、不锈钢、硬铝都是合金
⑦Al和Fe在一定条件下都能与某些氧化物反应
⑧化学键可以使离子相结合,也可以使原子相结合.
| A. | ③④⑤⑦ | B. | ②⑤⑥⑧ | C. | ①③④⑦ | D. | ③④⑤ |
10.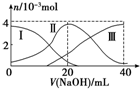 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化情况如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化情况如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化情况如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化情况如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )| A. | c(Na+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-) | B. | c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A)>c(OH-) | ||
| C. | c(Na+)>c(H+)>c(HA-)>c(A2-)>c(OH-)>c(H2A) | D. | c(Na+)>c(OH-)>c(HA-)>c(H2A)>c(H+)>c(A2-) |
9.下列各式表示水解反应的是( )
0 167903 167911 167917 167921 167927 167929 167933 167939 167941 167947 167953 167957 167959 167963 167969 167971 167977 167981 167983 167987 167989 167993 167995 167997 167998 167999 168001 168002 168003 168005 168007 168011 168013 168017 168019 168023 168029 168031 168037 168041 168043 168047 168053 168059 168061 168067 168071 168073 168079 168083 168089 168097 203614
| A. | HCO3-+H2O?H3O++CO32- | B. | HS-+H2O?H2S+OH- | ||
| C. | H2PO4-+H2O?HPO42-+H3O+ | D. | HCO3-+OH-?H2O+CO32- |
 甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:
甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题: .
.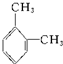 名称:邻二甲苯或1,2-二甲基苯
名称:邻二甲苯或1,2-二甲基苯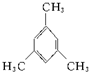 名称:1,3,5-三甲基苯.
名称:1,3,5-三甲基苯.