题目内容
11.(1)元素M的离子与NH4+所含电子数和质子数均相同,现M的原子结构示意图为 .
.(2)硫酸铝溶液与过量氨水反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+
(3)能证明Na2SO3溶液中存在SO32-+H2O?HSO3-+OH-水解平衡的事实是C(填序号).
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去.
分析 (1)N的质子数为7,H的质子数为1,所以NH4+中质子数为11,电子数为10个,据此解答;
(2)硫酸铝溶液与氨水反应可生成氢氧化铝沉淀和硫酸铵;
(3)如果亚硫酸钠不水解,则溶液中氢氧根离子和氢离子浓度相等,溶液呈中性,向溶液中加入酚酞后溶液不变色,加入和亚硫酸根离子反应的物质后,溶液红色褪色,则证明存在水解平衡.
解答 解:(1)N的质子数为7,H的质子数为1,NH4+中含有10个电子,11个质子,与之相同的单核离子为钠离子,则M的原子结构示意图为 ,
,
故答案为: ;
;
(2)硫酸铝溶液与氨水反应可生成氢氧化铝沉淀和硫酸铵,氢氧化铝不能溶于弱碱,则该反应为Al2(SO4)3+6NH3.H2O═2Al(OH)3↓+3(NH4)2SO4,其离子反应为2Al3++3NH3.H2O═2Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)A.滴入酚酞试液变红,说明溶液呈碱性,再加入硫酸溶液后,生成具有漂白性的SO2,溶液褪色,不能说明存在SO32-+H2O?HSO3-+OH-水解平衡,故A错误;
B.滴入酚酞试液变红,再加入氯水后,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,能使红色褪色,氯气具有强氧化性,Cl2+SO32-+H2O═SO42-+2Cl-+2H+,Cl2+HSO3-+H2O═SO4 2-+2Cl-+3H+,氯气和碱发生歧化反应,Cl2+2OH-═ClO-+Cl-+H2O,溶液褪色,不能说明存在SO32-+H2O?HSO3-+OH-水解平衡,故B错误;
C.滴入酚酞试液变红,说明溶液中氢氧根离子浓度大于氢离子浓度,再加入氯化钡溶液后,钡离子和亚硫酸根离子反应而和亚硫酸氢根离子不反应,钡离子和亚硫酸根离子反应生成亚硫酸钡沉淀,且溶液红色褪去,所以说明存在SO32-+H2O?HSO3-+OH-水解平衡,故C正确;
故选C.
点评 本题较为综合,主要考查推断和逻辑分析能力,明确物质的性质及发生的化学反应是解答的关键,题目难度中等.

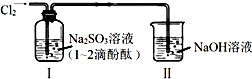
| A. | 通入Cl2后,装置Ⅰ中发生了氧化还原反应 | |
| B. | Cl2与Na2SO3溶液反应的离子方程式是:SO32-+Cl2+H2O=SO42-+2Cl-+2H+ | |
| C. | 通入Cl2后,装置Ⅰ中溶液不褪色 | |
| D. | 装置Ⅱ的作用是吸收尾气,防止污染空气 |
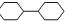 ,它的二氯代物且氯原子不在同一个环上的同分异构体的个数是( )
,它的二氯代物且氯原子不在同一个环上的同分异构体的个数是( )| A. | 13 | B. | 12 | C. | 11 | D. | 10 |
| A. | 2.24L | B. | 1.12L | C. | 0.672L | D. | 0.448L |
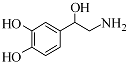
| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 每个去甲肾上腺素分子中含有2个手性碳原子 | |
| C. | 1mol去甲肾上腺素最多能与2molBr2发生取代反应 | |
| D. | 去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
| A. | 丙烯与氯化氢加成 | B. | 2-溴丙烷与NaOH醇溶液共热 | ||
| C. | 1-溴丁烷与NaOH醇溶液共热 | D. | 1-溴丙烷与NaOH溶液共热 |
| A. | 液态钠可用作核反应堆的传热介质 | |
| B. | 在过渡元素中找寻半导体材料 | |
| C. | 考古时利用l4C测定一些文物的年代 | |
| D. | SiO2是光导纤维的成分 |