题目内容
15.有关说法中正确的是( )| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | P4和CH4都是正四面体型结构的分子,且键角都为109°28ˊ | |
| C. | 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 | |
| D. | 电子层结构相同的简单离子,其半径随核电荷数增大而减小 |
分析 A.键长越短,键能越大;
B.白磷分子中键角为60°;
C.某元素由化合态变为游离态,化合可能升高,也可能降低;
D.电子层结构相同的简单离子,其核电荷数越大,对核外电子的引力越强,半径越小.
解答 解:A.键长越短,键能越大,分子越稳定,故A错误;
B.P4和CH4都是正四面体型结构的分子,白磷分子中键角为60°,甲烷的键角为109°28ˊ,故B错误;
C.某元素由化合态变为游离态,化合可能升高,也可能降低,如S2-变为S,化合价升高被氧化,SO2变为S,化合价降低被还原,故C错误;
D.电子层结构相同的简单离子,其核电荷数越大,对核外电子的引力越强,半径越小,则电子层结构相同的简单离子,其半径随核电荷数增大而减小,故D正确.
故选D.
点评 本题考查了共价键、键角、氧化还原反应、离子半径比较等,题目难度不大,侧重于基础知识的考查.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
18.短周期元素X、Y、Z、W的原子序数依次增大,X-、Y2+与Ne原子电子层相同,Z是金属,W的最外层电子数是内层电子总数的一半,下列说法正确的是( )
| A. | 原子半径:r(X)>r(Y)>r(Z)>r(W) | |
| B. | X的简单气态氢化物的稳定性比W的弱 | |
| C. | X分别与Y、W形成的化合物中化学键类型相同 | |
| D. | Y的最高价氧化物对应的水化物碱性比Z的强 |
6.铝箔在空气中加热,金属熔化而不滴落的原因是( )
| A. | 熔化的金属铝非常黏稠 | |
| B. | 铝的密度小,所受重力也小 | |
| C. | 大部分铝已经被氧化 | |
| D. | 氧化膜的熔点比铝高,兜住了熔化的铝 |
3.下列对三种有机物的叙述不正确的是( )
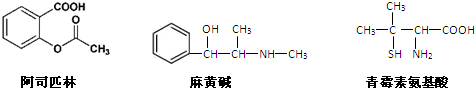

| A. | 青霉素氨基酸不能与盐酸反应,但能与NaOH溶液反应 | |
| B. | 阿司匹林能与NaOH溶液反应生成可溶性有机物 | |
| C. | 麻黄碱的分子式是C10H15NO,苯环上的一氯代物有3种 | |
| D. | 三种有机物都能发生酯化反应 |
10.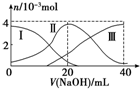 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化情况如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化情况如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化情况如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化情况如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )| A. | c(Na+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-) | B. | c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A)>c(OH-) | ||
| C. | c(Na+)>c(H+)>c(HA-)>c(A2-)>c(OH-)>c(H2A) | D. | c(Na+)>c(OH-)>c(HA-)>c(H2A)>c(H+)>c(A2-) |
4.下列化学用语的表述不正确的是( )
| A. | 过氧化氢的结构式:H-O-O-H | B. | 氮原子的L层电子轨道表示式: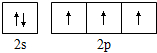 | ||
| C. | CO2的比例模型: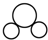 | D. | Cl-的结构示意图: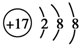 |
5.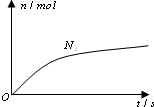 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )
 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )| A. | 反应后溶液的酸性明显增强 | |
| B. | 消耗1 mol还原剂,转移6 mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 该反应的还原剂是Cl- |
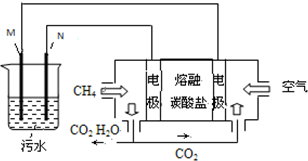 工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.
工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.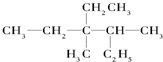 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷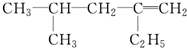
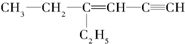 ,分子中饱和碳原子数为4个,可能在同一平面上的碳原子数最多为8个
,分子中饱和碳原子数为4个,可能在同一平面上的碳原子数最多为8个