10.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 4.6克钠与水反应时失去的电子数目为0.2NA | |
| B. | 1 L0.5mol•L-1 Na2SO4溶液中所含有的Na+离子数日为NA | |
| C. | 在标准状况下,22.4LNH3所含的氨分子数目为NA | |
| D. | 常温常压下2克氢气所含原子数日为NA |
9.A、B、C、x均为中学化学常见物质,且A、B、C含有同一种元素,在一定条件下发生如图所示的化学变化.则x不可能是( )A$\stackrel{X}{→}$B$\stackrel{X}{→}$C.
| A. | Al | B. | C | C. | O2 | D. | Fe |
8.工业上电解法制铝原理如图.下列说法正确的是( )
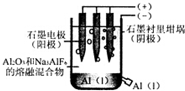

| A. | 电解过程中每转移12 mol电子,会产生2 molO2 | |
| B. | 加入助熔剂冰晶石(Na3AIF6)可降低电解的温度 | |
| C. | 电解过程中阳极反应式4A13++12e-→4Al | |
| D. | 若用该装置电解氯化铝溶液也能得到金属铝 |
7.下表是元素周期表的一部分,Y原子最外层电子数是次外层电子数的3倍,下列说法正确的是( )
| X | Y | ||
| M | Z |
| A. | 简单氢化物稳定性:X>Z | B. | 简单离子半径:Y<M | ||
| C. | 最高价氧化物水化物的酸性:X<Z | D. | 得电子能力:X>Y |
6.下列说法正确的是( )
| A. | CH2═CH2和CH3CH2C1都属于烃 | B. | 乙烯和乙烷都能发生加聚反应 | ||
| C. | 米酒变酸的过程涉及氧化反应 | D. | 未成熟的苹果遇碘水不会变蓝 |
5.A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质.已知:甲+乙=丁+辛,甲+丙=戊+辛;常温下0.l mol•L-1丁溶液的pH为13.下列说法正确的是( )
| A. | 元素B在周期表中的位置为第二周期第VIA族 | |
| B. | 元素B、C、D的原子半径由大到小的顺序为r(D)>r(C)>r(B) | |
| C. | 1 mol甲与足量的乙完全反应共转移了约6.02×1023个电子 | |
| D. | 1.0L 0.lmol-L-1戊溶液中阴离子总的物质的量小于0.l mol |
2. 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )
 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )| A. | 电池放电时Na+从a极区移向b极区 | |
| B. | 电极b采用MnO2,MnO2既作电极材料又有还原作用 | |
| C. | 该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O | |
| D. | 每消耗3 mol H2O2,转移的电子为6 mol |
1.元素周期表和元素周期律可以指导人们进行规律性的推测和判断.下列说法不合理的是( )
0 167895 167903 167909 167913 167919 167921 167925 167931 167933 167939 167945 167949 167951 167955 167961 167963 167969 167973 167975 167979 167981 167985 167987 167989 167990 167991 167993 167994 167995 167997 167999 168003 168005 168009 168011 168015 168021 168023 168029 168033 168035 168039 168045 168051 168053 168059 168063 168065 168071 168075 168081 168089 203614
| A. | 由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:Cl>F | |
| B. | 人们可在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料 | |
| C. | 短周期元素正化合价数值和其族序数相同 | |
| D. | 短周期元素形成的微粒X2-与 Y2+核外电子排布相同,离子半径:X2->Y2+ |


 .
. .
. ,反应类型酯化反应.
,反应类型酯化反应. )
) .
.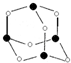 主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.
主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.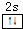 ,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.
,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.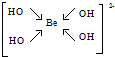 ,1mol该离子中含有的共价键数目为8NA.
,1mol该离子中含有的共价键数目为8NA.