题目内容
5.A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质.已知:甲+乙=丁+辛,甲+丙=戊+辛;常温下0.l mol•L-1丁溶液的pH为13.下列说法正确的是( )| A. | 元素B在周期表中的位置为第二周期第VIA族 | |
| B. | 元素B、C、D的原子半径由大到小的顺序为r(D)>r(C)>r(B) | |
| C. | 1 mol甲与足量的乙完全反应共转移了约6.02×1023个电子 | |
| D. | 1.0L 0.lmol-L-1戊溶液中阴离子总的物质的量小于0.l mol |
分析 0.1 mol/L 丁溶液的pH为13(25℃),丁是一元强碱,其含有的金属元素在短周期,则丁应为NaOH,发生反应:甲+乙=丁+辛,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,辛是由C组成的单质,由发生反应可知,辛不能是Na,结合原子数可知,A为H、C为O、D为Na元素,故辛为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+辛,可知丙是二氧化碳,戊是碳酸钠,则B为碳元素,结合对应单质、化合物的性质以及题目要求可解答该题.
解答 解:0.1 mol/L 丁溶液的pH为13(25℃),丁是一元强碱,其含有的金属元素在短周期,则丁应为NaOH,发生反应:甲+乙=丁+辛,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,辛是由C组成的单质,由发生反应可知,辛不能是Na,结合原子数可知,A为H、C为O、D为Na元素,故辛为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+辛,可知丙是二氧化碳,戊是碳酸钠,则B为碳元素,
A.Y为碳,在周期表中的位置为:第二周期第ⅣA族,故A错误;
B.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径大小顺序为:Na>C>O,即:D>B>C,故B错误;
C.甲与足量的乙完全反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,1molNa2O2反应转移的电子为1mol,约6.02×1O23个电子,故C正确;
D.戊是碳酸钠,在碳酸钠溶液中,CO32-离子水解生成HCO3-离子和OH-离子,溶液中阴离子总的物质的量大于0.1mol,故D错误,
故选C.
点评 本题为元素化合物推断,题目难度中等,需要学生熟练掌握元素化合物知识,对学生的逻辑推理有一定的要求,D选项注意盐类水解.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 生石灰 | AlCl3溶液 | Al(OH)3具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 醋酸 | Na2CO3 | Na2SiO3 | 非金属性:C>Si |
| A. | A | B. | B | C. | C | D. | D |
| A. | 铝和铜常用于导电体,铝被人类大规模开发、使用的时间远超过铜被人类大规模开发和使用的时间 | |
| B. | 使用煤液化的产品作燃料与直接燃烧煤比较,对保护环境有利,目前,煤液化的唯一途径是将煤在高温和催化剂条件下与氢气反应 | |
| C. | 石油分馏的馏分之一是石油气,石油气含有大量的己烷 | |
| D. | 在陶瓷、聚合物中加入固态胶体粒子,可以改进材料的耐冲击强度和耐断裂强度 |
| A. | pH=1的无色溶液中:K+、NH4+、SO42-、MnO4- | |
| B. | 水电离出的c(OH-)=10-12 mo1•L-1的溶液中:Fe2+、Ba2+、NO3-、ClO- | |
| C. | 含大量A13+的溶液中:Na+、SO42-、NO3-、[Al(OH)4]- | |
| D. | CO2的饱和溶液中:K+、Ca2+、Cl-、NO3- |
| A. | 4.6克钠与水反应时失去的电子数目为0.2NA | |
| B. | 1 L0.5mol•L-1 Na2SO4溶液中所含有的Na+离子数日为NA | |
| C. | 在标准状况下,22.4LNH3所含的氨分子数目为NA | |
| D. | 常温常压下2克氢气所含原子数日为NA |
| A. | Fe2O3溶于HI溶液中:Fe2O3+6H+=2Fe3++3H2O | |
| B. | [Ag(NH3)2]OH的溶液中加入盐酸:Ag++Cl-=AgCl↓ | |
| C. | Na2S2O3溶液吸收Cl2:4Cl2+S2O32-+5H2O=10H++2SO42-+8Cl- | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液:NH4++Fe2++3OH-=Fe (OH)2↓+NH3•H2O |
| A. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| B. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| C. | 食品保鲜膜、一次性食品袋的主要成分是聚乙烯 | |
| D. | 使用纤维素和淀粉为原料制成的微生物降解塑料,可治理“白色污染” |
| A. | NaF、NaCl、NaBr、NaI的熔点依次升高 | |
| B. | 熔点:铯>钾>钠>钠和钾的合金 | |
| C. | 熔沸点:HI>HBr>HCl>HF | |
| D. | 热稳定性:HF>HCl>HBr>HI |
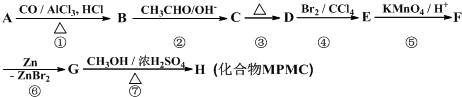

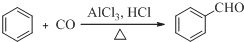
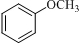 ;D
;D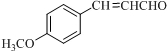 .
.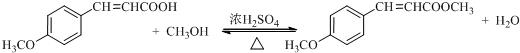 .
.