11.(1)在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1所示.
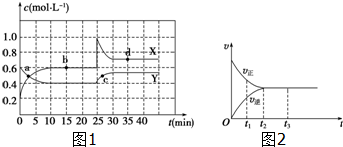
①该反应的化学方程式为(反应物或生成物用符号X、Y表示):Y?2X.
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是bd.
(2)图2是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线.下列叙述正确的是bd.
a.t1时,只有正方向反应
b.t2时,反应达到限度
c.t2~t3,反应不再发生
d.t2~t3,各物质的浓度不再发生变化
(3)表中列出的是某温度和压强下,2L容器中,化学反应2SO2+O2?2SO3在不同时间点测得密闭体系中三种物质的物质的量
根据以上数据回答问题:
①计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075 mol•L-1•s-1 mol/(L•min)-1.
②反应70s后,其他条件不变,只改变一个条件,使反应速率增大.则该条件可能是(要求:写出3点即可)a.加入催化剂,b.升高温度,c.增大浓度.

①该反应的化学方程式为(反应物或生成物用符号X、Y表示):Y?2X.
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是bd.
(2)图2是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线.下列叙述正确的是bd.
a.t1时,只有正方向反应
b.t2时,反应达到限度
c.t2~t3,反应不再发生
d.t2~t3,各物质的浓度不再发生变化
(3)表中列出的是某温度和压强下,2L容器中,化学反应2SO2+O2?2SO3在不同时间点测得密闭体系中三种物质的物质的量
| 时间(s) 物质的量(mol) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.01 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
①计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075 mol•L-1•s-1 mol/(L•min)-1.
②反应70s后,其他条件不变,只改变一个条件,使反应速率增大.则该条件可能是(要求:写出3点即可)a.加入催化剂,b.升高温度,c.增大浓度.
9.下列烷烃的系统命名中,正确的是( )
| A. | 2,3-二甲基丁烷 | B. | 2-二甲基戊烷 | ||
| C. | 3,3-二甲基丁烷 | D. | 3-甲基-2-乙基己烷 |
8.下列分子式表示的物质一定是纯净物的是( )
| A. | C4H10 | B. | CH2Cl2 | C. | C2H4O2 | D. |  |
6.电子构型为[Ar]3d54s2的元素是( )
| A. | 过渡元素 | B. | 稀有气体 | C. | 主族元素 | D. | 卤族元素 |
4.下列各组中的性质比较,正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:KOH>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性:HCl<H2S<PH3 | D. | 原子半径:Na<Mg<Al |
3.四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
(1)写出Z在元素周期表中的位置第三周期第ⅣA 族.
(2)X的最高价氧化物的电子式为 ,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(3)W的最高价氧化物对应的水化物属于共价化合物,(填“离子”或“共价”),W和Z形成的气态氢化物的稳定性大小关系是:NH3>SiH4.(用化学式表示)
W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似(醋酸为一元弱酸),体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH=NaN3+H2O(方程式中各物质用化学式表示)
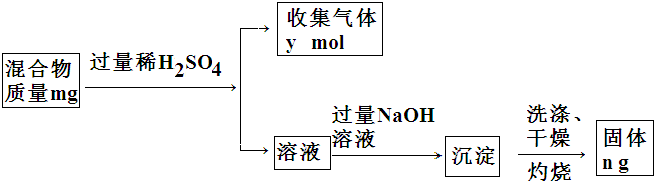
(4)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y
| W | X | Y | Z | |
| 结构或 性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应 呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小,它的最高价氧化物为两性氧化物 | 最高正价与最低负价之和为零 |
(2)X的最高价氧化物的电子式为
 ,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.(3)W的最高价氧化物对应的水化物属于共价化合物,(填“离子”或“共价”),W和Z形成的气态氢化物的稳定性大小关系是:NH3>SiH4.(用化学式表示)
W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似(醋酸为一元弱酸),体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH=NaN3+H2O(方程式中各物质用化学式表示)
(4)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y

2.将纯锌片和纯铜片用导线连接后放入稀硫酸中发生原电池反应,下列叙述正确的是( )
0 167839 167847 167853 167857 167863 167865 167869 167875 167877 167883 167889 167893 167895 167899 167905 167907 167913 167917 167919 167923 167925 167929 167931 167933 167934 167935 167937 167938 167939 167941 167943 167947 167949 167953 167955 167959 167965 167967 167973 167977 167979 167983 167989 167995 167997 168003 168007 168009 168015 168019 168025 168033 203614
| A. | 正极有O2逸出 | B. | 负极附近的SO42-浓度逐渐增大 | ||
| C. | 电子通过导线由铜片流向锌片 | D. | 铜片表面发生氧化反应 |
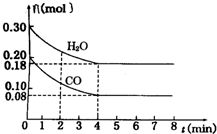 在一体积为2L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)
在一体积为2L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)