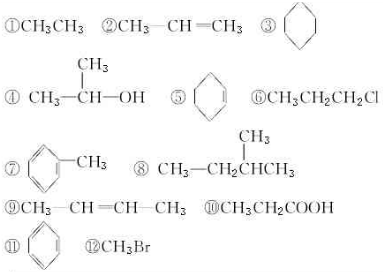
题目内容
4.下列各组中的性质比较,正确的是( )| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:KOH>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性:HCl<H2S<PH3 | D. | 原子半径:Na<Mg<Al |
分析 A、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B、元素的金属性越强,对应的最高价氧化物的碱性越强;
C、非金属性越强,气态氢化物越稳定;
D、同周期元素从左到右,原子半径逐渐减小.
解答 解:A、非金属性Cl>Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故A正确;
B、金属性K>Ca>Mg,元素的金属性越强,对应的最高价氧化物的碱性越强,故B正确;
C、非金属性Cl>S>P,非金属性越强,气态氢化物越稳定,所以稳定性HCl>H2S>PH3,故C错误;
D、同周期元素从左到右,原子半径逐渐减小,原子半径:Na>Mg>Al,故D错误;
故选AB.
点评 本题考查元素周期律的递变规律,题目难度不大,注意把握元素的递变规律以及与对应单质、化合物的性质的关机以及比较角度.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
15.要检验某溴乙烷中的溴元素,正确的实验方法是( )
| A. | 加入氯水振荡,观察水层是否有棕红色溴出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸呈酸性,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
12.用下列装置进行相应实验,能达到实验目的是( )
| A. |  图为牺牲阳极的阴极保护法,可以防止铁棒被腐蚀 | |
| B. |  图所示装置可以检验溴乙烷与NaOH醇溶液共热产生的乙烯 | |
| C. |  图所示装置可以用来制备氢氧化亚铁 | |
| D. |  图所示装置可以用来测定中和热 |
9.下列烷烃的系统命名中,正确的是( )
| A. | 2,3-二甲基丁烷 | B. | 2-二甲基戊烷 | ||
| C. | 3,3-二甲基丁烷 | D. | 3-甲基-2-乙基己烷 |
13.下列各氢化物中,稳定性按由强到弱的顺序排列的是( )
| A. | HBr>HF>HCl | B. | HCl>HF>HBr | C. | HF>HCl>HBr | D. | HCl>HBr>HF |
14.有机物A的键线式结构为  ,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
 ,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )| A. | 有机物A的一氯取代物只有4种 | |
| B. | 用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷 | |
| C. | 有机物A的分子式为C8H18 | |
| D. | B的结构可能有3种,其中一种名称为3,4,4-三甲基-2-戊烯 |