题目内容
2.将纯锌片和纯铜片用导线连接后放入稀硫酸中发生原电池反应,下列叙述正确的是( )| A. | 正极有O2逸出 | B. | 负极附近的SO42-浓度逐渐增大 | ||
| C. | 电子通过导线由铜片流向锌片 | D. | 铜片表面发生氧化反应 |
分析 该原电池中,较活泼的金属锌作负极,负极上锌失电子发生氧化反应;铜作正极,正极上氢离子得电子发生还原反应生成氢气;电子从负极沿导线流向正极;溶液中阴离子向负极移动,阳离子向正极移动,据此分析.
解答 解:A、正极上氢离子得电子生成氢气,故A错误;
B、原电池放电时,溶液中阴离子向负极移动,所以阴极附近的SO42-浓度逐渐增大,故B正确;
C、原电池放电时,电子从负极沿导线流向正极,即电子通过导线由锌片流向铜片,故C错误;
D、铜片作正极,正极上氢离子得电子发生还原反应生成氢气,故D错误;
故选B.
点评 本题考查了原电池的工作原理,难度不大,难点是判断溶液中阴阳离子的移动方向,很多学生认为阴离子向正极移动,阳离子向负极移动.

练习册系列答案
相关题目
13.1993年的世界十大科技新闻称:中国学者许志福和美国科学家穆尔共同合成了世界上最大的碳氢分子,其中1个分子由1134个碳原子和1146个氢原子构成.关于此物质,下列说法错误的是( )
| A. | 是烃类化合物 | B. | 常温下呈固态 | ||
| C. | 具有类似金刚石的硬度 | D. | 易被氧化 |
17.将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小排列的顺序是( )
①20mL 0.01mol•L-1NH4Cl溶液
②30mL 0.02mol•L-1 CaCl2溶液
③40mL 0.03mol•L-1盐酸
④10mL蒸馏水
⑤50mL 0.05mol•L-1AgNO3溶液.
①20mL 0.01mol•L-1NH4Cl溶液
②30mL 0.02mol•L-1 CaCl2溶液
③40mL 0.03mol•L-1盐酸
④10mL蒸馏水
⑤50mL 0.05mol•L-1AgNO3溶液.
| A. | ①②③④⑤ | B. | ④①③②⑤ | C. | ⑤④②①③ | D. | ④③⑤②① |
14.已知钋的原子序数是84,是一种放射性元素,被称为世界上最毒的物质,是推测它在周期表的位置( )
| A. | 第四周期第ⅢA族 | B. | 第六周期第ⅥA族 | C. | 第五周期第ⅥA族 | D. | 第六周期第ⅦA族. |
11.有机物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得到分子式为C5H10的两种产物Y、Z.Y、Z经催化加氢后都可得到2-甲基丁烷.则X的结构简式可能为( )
| A. | CH3CH2CH2CH2CH2Cl | B. |  | ||
| C. |  | D. | 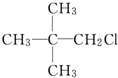 |
12.X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大.下列说法正确的是( )
| A. | M与X形成的化合物对应的水化物一定是强酸 | |
| B. | Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 | |
| C. | X、Y的简单离子半径:r(X2-)>r(Y+) | |
| D. | X的气态氢化物比M的气态氢化物稳定 |
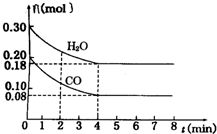 在一体积为2L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)
在一体积为2L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)