18.下列说法正确的是( )
①离子化合物一定含离子键,也可能含共价键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物.
①离子化合物一定含离子键,也可能含共价键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物.
| A. | ①③⑤ | B. | ②④⑥ | C. | ②③④ | D. | ①③⑥ |
17.医学界通过用放射性14C标记的C60,发现C60的羧酸衍生物在特定条件下可断裂DNA杀死细胞,抑制艾滋病.关于14C的下列说法中正确的是( )
| A. | 14C原子与C60中普通碳原子的化学性质相同 | |
| B. | 14C原子与14N原子所含中子数相同 | |
| C. | 14C是C60的同素异形体 | |
| D. | 14CO与12CO、13CO是碳元素的三种同位素 |
16.在“部分酸碱盐溶解性表”中存在“碳酸亚铁”.某学习小组设计实验探究碳酸亚铁的性质.
(一)制备碳酸亚铁.
将一定量新制备的硫酸亚铁溶液和过量的碳酸氢铵溶液混合产生大量沉淀和气体.
(1)写出离子方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(二)探究碳酸亚铁的热稳定性(加热仪器省略)
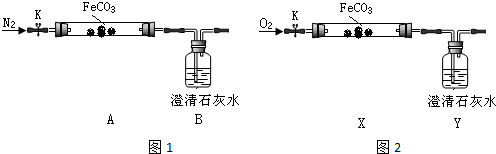
连接仪器、装药品.打开K,先通入一段时间氮气,然后,用酒精喷灯在A处加热玻璃管,观察B瓶溶液变浑浊.待固体分解完后,继续通入氮气至玻璃管冷却.
(2)先通入氮气的目的是排尽装置内空气,避免氧气干扰.B瓶现象能说明分解产物有二氧化碳.
(3)停止加热之前,是否拆开A、B之间橡胶管?答:否;理由是通入氮气,玻璃管内气压不会减小.
(三)探究碳酸亚铁还原性
【查阅资料】
①氧化亚铁是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁.
②碳酸亚铁在空气中灼烧生成氧化铁.
(4)探究碳酸亚铁和氧气反应的固体成分:
①【提出设想】
假设1 固体成分是氧化铁;
假设2 固体成分是四氧化三铁;
假设3氧化铁和四氧化三铁.
②【实验验证】连接仪器、装药品,打开止水夹K,通入氧气,加热玻璃管.Y瓶中澄清石灰水不产生沉淀时,停止加热,继续通入氧气至玻璃管冷却.
取少量玻璃管里固体于试管,滴加稀硫酸,微热,固体完全溶解.将溶液分成甲、乙两份溶液,进行后续实验.
【实验评价】③上述实验i(填:i或ii)不能确定样品成分.
【实验结论】根据上述实验结果,该小组得到碳酸亚铁在氧气中高温灼烧得到产物是溶液变红色,只证明有+3价铁,固体可能是氧化铁、四氧化三铁、氧化铁和四氧化三铁混合物.
(5)定量探究:取23.2g纯净固体碳酸亚铁,在空气中高温灼烧至恒重,称得固体质量净减7.2g.通过计算确定固体成分是氧化铁.
(一)制备碳酸亚铁.
将一定量新制备的硫酸亚铁溶液和过量的碳酸氢铵溶液混合产生大量沉淀和气体.
(1)写出离子方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(二)探究碳酸亚铁的热稳定性(加热仪器省略)

连接仪器、装药品.打开K,先通入一段时间氮气,然后,用酒精喷灯在A处加热玻璃管,观察B瓶溶液变浑浊.待固体分解完后,继续通入氮气至玻璃管冷却.
(2)先通入氮气的目的是排尽装置内空气,避免氧气干扰.B瓶现象能说明分解产物有二氧化碳.
(3)停止加热之前,是否拆开A、B之间橡胶管?答:否;理由是通入氮气,玻璃管内气压不会减小.
(三)探究碳酸亚铁还原性
【查阅资料】
①氧化亚铁是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁.
②碳酸亚铁在空气中灼烧生成氧化铁.
(4)探究碳酸亚铁和氧气反应的固体成分:
①【提出设想】
假设1 固体成分是氧化铁;
假设2 固体成分是四氧化三铁;
假设3氧化铁和四氧化三铁.
②【实验验证】连接仪器、装药品,打开止水夹K,通入氧气,加热玻璃管.Y瓶中澄清石灰水不产生沉淀时,停止加热,继续通入氧气至玻璃管冷却.
取少量玻璃管里固体于试管,滴加稀硫酸,微热,固体完全溶解.将溶液分成甲、乙两份溶液,进行后续实验.
| 实验编号 | 实验步骤 | 实验现象 |
| i | 向甲溶液滴加KSCN溶液 | 溶液变红色 |
| ii | 向乙溶液滴加酸性高锰酸钾溶液 | 溶液不褪色 |
【实验结论】根据上述实验结果,该小组得到碳酸亚铁在氧气中高温灼烧得到产物是溶液变红色,只证明有+3价铁,固体可能是氧化铁、四氧化三铁、氧化铁和四氧化三铁混合物.
(5)定量探究:取23.2g纯净固体碳酸亚铁,在空气中高温灼烧至恒重,称得固体质量净减7.2g.通过计算确定固体成分是氧化铁.
14.用化学试剂鉴别下列各组物质,填写所用试剂和相应的实验现象.
| 鉴别对象 | 所用试剂 | 实验现象 |
| 苯和苯酚 | 加入FeCl3溶液 | 苯无现象,苯酚溶液呈紫色 |
| 苯和甲苯 | 加入酸性高锰酸钾溶液 | 苯不能使高锰酸钾溶液褪色,甲苯能使高锰酸钾溶液褪色 |
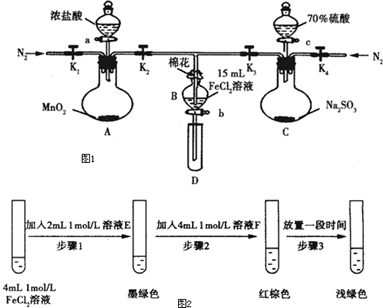
13.为验证氧化性Cl2>Fe3+>SO2,某小组用如图1所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
实验过程:
Ⅰ.打开弹簧夹K1~K4,通过一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K2、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K2,活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K2.
Ⅵ.更换试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰实验.
(2)棉花中浸润的溶液为NaOH溶液.
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%硫酸中氢离子浓度大于98%的硫酸,因此反应速率更快.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色.
查阅资料:Fe2+(aq)+2SO32-(aq)?FeSO3(s)(墨绿色)
提出假设:FeCl2与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.
某同学设计如图2实验,证实该假设成立:
①溶液E和F分别为Na2SO3、FeCl3.
②请用离子方程式解释步骤3中溶液(酸性)由红棕色变浅绿色的原因Fe3+消耗SO32-,c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)逆向移动,溶液颜色由红棕色变为浅绿色.

实验过程:
Ⅰ.打开弹簧夹K1~K4,通过一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K2、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K2,活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K2.
Ⅵ.更换试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰实验.
(2)棉花中浸润的溶液为NaOH溶液.
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%硫酸中氢离子浓度大于98%的硫酸,因此反应速率更快.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
| 过程Ⅳ:B溶液中含有的离子 | 过程Ⅵ:B溶液中含有的离子 | |
| 甲 | 有Fe3+,无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+、又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+、无Fe2+ | 有Fe2+ |
查阅资料:Fe2+(aq)+2SO32-(aq)?FeSO3(s)(墨绿色)
提出假设:FeCl2与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.
某同学设计如图2实验,证实该假设成立:
①溶液E和F分别为Na2SO3、FeCl3.
②请用离子方程式解释步骤3中溶液(酸性)由红棕色变浅绿色的原因Fe3+消耗SO32-,c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)逆向移动,溶液颜色由红棕色变为浅绿色.
12.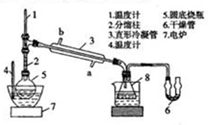 硼酸三甲酯可作溶剂、脱水剂和塑料、油漆、喷漆等的防火剂等.实验室合成硼酸三甲酯的反应、装置示意图及有关数据如下:
硼酸三甲酯可作溶剂、脱水剂和塑料、油漆、喷漆等的防火剂等.实验室合成硼酸三甲酯的反应、装置示意图及有关数据如下:
Na2B4O7•10H2O+2H2SO4+12CH3OH=2NaHSO4+4(CH3O)3B+17H2O
实验步骤:
在圆底烧瓶中加入44.8g甲醇和19.1gNa2B4O7•10H2O(硼砂,式量382)然后缓慢地加入浓H2SO4并振荡;用电炉加热烧瓶中的液体;回流一段时间后,先接收51~55℃的馏分,再接收55~60℃的馏分;两次所得馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离;精馏得高纯硼酸三甲酯19.2g.
回答下列问题:
(1)图中仪器8的名称是锥形瓶,直形冷凝管冷却水应从a(填字母)接口进入.
(2)装有P2O3的干燥管作用是防止空气中水蒸气进入导致硝酸三甲酯水解.
(3)采用较高的甲醇与硼砂的物质的量之比的目的是提高硼砂的转化率.
(4)两次馏分中含硼酸三甲酯含量较高的是第1(填“1”或“2”)次.
(5)盐析后分离出硼酸三甲酯所需的主要玻璃仪器是分液漏斗.
(6)精馏时应收集68℃的馏分.
(7)本次实验的产率是D.
A.42.9% B.46.6% C.64.5% D.92.3%
0 167807 167815 167821 167825 167831 167833 167837 167843 167845 167851 167857 167861 167863 167867 167873 167875 167881 167885 167887 167891 167893 167897 167899 167901 167902 167903 167905 167906 167907 167909 167911 167915 167917 167921 167923 167927 167933 167935 167941 167945 167947 167951 167957 167963 167965 167971 167975 167977 167983 167987 167993 168001 203614
 硼酸三甲酯可作溶剂、脱水剂和塑料、油漆、喷漆等的防火剂等.实验室合成硼酸三甲酯的反应、装置示意图及有关数据如下:
硼酸三甲酯可作溶剂、脱水剂和塑料、油漆、喷漆等的防火剂等.实验室合成硼酸三甲酯的反应、装置示意图及有关数据如下:Na2B4O7•10H2O+2H2SO4+12CH3OH=2NaHSO4+4(CH3O)3B+17H2O
| 硼酸三甲酯 | 甲醇 | |
| 相对分子量 | 104 | 32 |
| 溶解性 | 与乙醚、甲醇混溶,能水解 | 与水混溶 |
| 沸点/℃ | 68 | 64 |
| 备注 | 硼酸三甲酯与甲醇能形成共沸混合物,沸点54℃ | |
在圆底烧瓶中加入44.8g甲醇和19.1gNa2B4O7•10H2O(硼砂,式量382)然后缓慢地加入浓H2SO4并振荡;用电炉加热烧瓶中的液体;回流一段时间后,先接收51~55℃的馏分,再接收55~60℃的馏分;两次所得馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离;精馏得高纯硼酸三甲酯19.2g.
回答下列问题:
(1)图中仪器8的名称是锥形瓶,直形冷凝管冷却水应从a(填字母)接口进入.
(2)装有P2O3的干燥管作用是防止空气中水蒸气进入导致硝酸三甲酯水解.
(3)采用较高的甲醇与硼砂的物质的量之比的目的是提高硼砂的转化率.
(4)两次馏分中含硼酸三甲酯含量较高的是第1(填“1”或“2”)次.
(5)盐析后分离出硼酸三甲酯所需的主要玻璃仪器是分液漏斗.
(6)精馏时应收集68℃的馏分.
(7)本次实验的产率是D.
A.42.9% B.46.6% C.64.5% D.92.3%
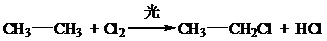 、取代反应
、取代反应 、取代反应.
、取代反应.