题目内容
19.氯气是一种重要的化工原料,在生产和生活中应用十分广泛.已知:2KMnO4+16HCl(浓)═2KCl+5Cl2↑+8H2O,所以在实验室可用高锰酸钾固体和浓盐酸制氯气.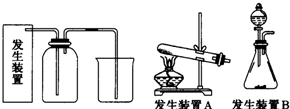
(1)请为该实验选择合适的发生装置B(填“A”或“B”).
(2)要得到纯净、干燥的氯气,在发生装置和集气瓶之间还需要放置2个洗气瓶,其中第一个洗气瓶内要盛放饱和食盐水(填试剂名称).
(3)当实验室中用软锰矿(主要成分是MnO2)和浓盐酸制取氯气时,反应的离子方程式为MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O,等物质的量的高锰酸钾固体和MnO2分别与足量浓盐酸反应时,产生氯气的体积比(同条件下)为5:2.
分析 (1)依据反应物状态和反应条件选择合适的发生装置;
(2)从发生装置中制取的氯气含有氯化氢和水蒸气杂质,应分别用盛有饱和食盐和浓硫酸的洗气瓶除去;
(3)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;
依据方程式:2KMnO4+16HCl(浓)═2KCl+5Cl2↑+8H2O,和方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,分别计算消耗等物质的量的高锰酸钾固体和MnO2生成的氯气的物质的量.
解答 解:(1)从方程式:2KMnO4+16HCl(浓)═2KCl+5Cl2↑+8H2O可知,反应物状态和反应条件分别为:固体+液体不加热,所以应选择B装置作为发生装置;
故答案为:B;
(2)氯气中混有氯化氢和水蒸气,要得到纯净、干燥的氯气,应先通过盛有饱和食盐水的洗气瓶除去氯化氢,再通过盛有浓硫酸的洗气瓶除去水蒸气,
故答案为:2;饱和食盐水;
(3)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
依据方程式2KMnO4+16HCl(浓)═2KCl+5Cl2↑+8H2O,消耗2mol高锰酸钾生成5mol氯气;
依据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,消耗2mol二氧化锰生成2mol氯气,
所以物质的量的高锰酸钾固体和MnO2分别与足量浓盐酸反应时,产生氯气的物质的量之比为5:2,等温等压条件下,气体的体积之比等于物质的量之比,故产生气体的体积之比为5:2;
故答案为:MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O; 5:2.
点评 本题考查了氯气的制备,明确反应原理和氯气的性质是解题关键,题目难度不大.

| A. | Na、Mg、Al原子的最外层电子数依次减少 | |
| B. | N、O、F元素的最高正价依次升高 | |
| C. | C、N、O的原子半径依次减小 | |
| D. | Li、Na、K的金属性依次减弱 |
| A. | 蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 | |
| B. | 石油裂解和油脂皂化都是高分子生成小分子的过程 | |
| C. | 分子式为C2H4O2且能与NaOH溶液反应的有机物一定是乙酸 | |
| D. | 乙醇、乙酸和乙醛能用新制Cu(OH)2悬浊液鉴别 |
| 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 | |
| 密度/(g/cm3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 118.0 | 118.1 | 126.1 | 142 |
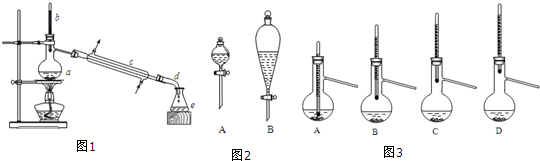
分离提纯:①将仪器a中反应后的混合液与仪器e中的馏出物合并,转入分液漏斗中;②依次用水、少量的10%碳酸钠溶液和水洗涤,分离后再加干燥剂M,静置一段时间后,弃去M;③将最终得到的反应粗产物转入洗净的仪器a中,加入几粒沸石,进行蒸馏,得到乙酸正丁酯7.31g.
请回答下列问题:
(1)仪器a的名称是蒸馏烧瓶.
(2)在分液时应选如图2装置中的B(填序号),使用该仪器前应先检漏.
(3)写出制备乙酸正丁酯的化学方程式:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)第一次水洗的目的是除去硫酸及部分乙酸.
(5)干燥剂M可以是B(填序号)
A.五氧化二磷 B.无水硫酸钠 C.碱石灰 D.氢氧化钠固体
(6)步骤③得到的粗产品蒸馏提纯时,图3所示装置中,温度计位置可能导致收集到的产品中混有高沸点杂质的装置为D(填序号)
(7)本实验所得到的乙酸正丁酯的产率是C(填序号)
A.30% B.40% C.50% D.55%
| 鉴别对象 | 所用试剂 | 实验现象 |
| 苯和苯酚 | 加入FeCl3溶液 | 苯无现象,苯酚溶液呈紫色 |
| 苯和甲苯 | 加入酸性高锰酸钾溶液 | 苯不能使高锰酸钾溶液褪色,甲苯能使高锰酸钾溶液褪色 |
| A. | 碘和氯化钾 | B. | 金刚石和冰晶石 | C. | 二氧化硅和干冰 | D. | 冰和冰醋酸 |
| A. | Na、Mg、Al原子最外层电子数依次减少 | |
| B. | C、N、O元素非金属性依次增强 | |
| C. | C、N、O元素最高正价依次增大 | |
| D. | Li、Na、K的金属性依次减弱 |
| A. | 2Q1+Q2>Q3 | B. | Q1+Q2>2Q3 | C. | 2Q1+Q2<4Q3 | D. | 2Q1+Q2<2Q3 |
