13.电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn+2OH--2e-═Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-═Ag+2OH-,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.下列说法正确的是( )
| A. | 锌是正极,氧化银是负极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液的pH基本保持不变 |
12.氢-氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-═2H2O和 O2+2H2O+4e-═4OH-.则下列叙述正确的是( )
| A. | 通H2的一极是正极 | |
| B. | 通O2的一端极是负极 | |
| C. | 工作一段时间后电解质溶液pH增大 | |
| D. | 工作一段时间后电解质溶液pH减小 |
11.电解精炼粗铜时,下列叙述不正确的是( )
| A. | 与电源正极相连的电极是粗铜板 | B. | 阴极发生反应:Cu2++2e-═Cu | ||
| C. | 电解池的阳极材料为粗铜 | D. | 粗铜板上发生还原反应 |
10.用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液的pH下降的是( )
| A. | CuSO4 | B. | NaOH | C. | BaCl2 | D. | H2SO4 |
9.在2L密闭容器中,发生3A(g)+B(g)?2C(g)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12mol•L-1•s-1,则10s后容器中B的物质的量是( )
| A. | 1.6 mol | B. | 2.8 mol | C. | 3.2 mol | D. | 3.6 mol |
8.有关电化学知识的描述正确的是( )
| A. | 由于CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池 | |
| B. | 工业上冶炼铝2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑ | |
| C. | 原电池的两极一定是由活动性不同的两种金属组成 | |
| D. | 理论上说,不能自发进行的氧化还原反应都可设计成原电池 |
7.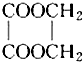 以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
①氧化反应 ②消去反应 ③加成反应 ④酯化反应 ⑤水解反应 ⑥加聚反应.
0 167795 167803 167809 167813 167819 167821 167825 167831 167833 167839 167845 167849 167851 167855 167861 167863 167869 167873 167875 167879 167881 167885 167887 167889 167890 167891 167893 167894 167895 167897 167899 167903 167905 167909 167911 167915 167921 167923 167929 167933 167935 167939 167945 167951 167953 167959 167963 167965 167971 167975 167981 167989 203614
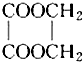 以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )①氧化反应 ②消去反应 ③加成反应 ④酯化反应 ⑤水解反应 ⑥加聚反应.
| A. | ②③①⑤④ | B. | ②③⑤④① | C. | ②③⑤①④ | D. | ②③⑤①⑥ |
 .
. 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图所示为电池示意图,该电池电极表面均匀地镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图所示为电池示意图,该电池电极表面均匀地镀一层细小的铂粉,铂吸附气体的能力强,性质稳定. 如图表示一个电解池,a是饱和NaCl溶液;X、Y都是石墨电极,U形管内滴入了几滴酚酞试液.请回答以下问题:
如图表示一个电解池,a是饱和NaCl溶液;X、Y都是石墨电极,U形管内滴入了几滴酚酞试液.请回答以下问题: