题目内容
12.氢-氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-═2H2O和 O2+2H2O+4e-═4OH-.则下列叙述正确的是( )| A. | 通H2的一极是正极 | |
| B. | 通O2的一端极是负极 | |
| C. | 工作一段时间后电解质溶液pH增大 | |
| D. | 工作一段时间后电解质溶液pH减小 |
分析 氢氧燃料电池是将化学能转变为电能的装置,工作时,通入氢气的一极为电池的负极,发生氧化反应,通入氧气的一极为电池的正极,发生还原反应,电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水.
解答 解:A、在燃料电池中,通入燃料氢气的一极为电池的负极,故A错误;
B、在燃料电池中,通入燃料氢气的一极为电池的负极,通入O2的一极是正极,故B错误;
C、氢氧燃料电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水,工作一段时间后电解质溶液的pH减小,故C错误;
D、氢氧燃料电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水,工作一段时间后电解质溶液的pH减小,故D正确.
故选D.
点评 本题考查原电池的组成以及工作原理,题目难度不大,注意电极反应式的书写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列递变规律正确的是( )
| A. | KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 | |
| B. | Na、Mg、Al、Si的金属性逐渐增强 | |
| C. | O、S、Na、K的原子半径依次增大 | |
| D. | HF、HCl、H2S、PH3的稳定性依次增强 |
3.下列变化中,不需要破坏化学键的是( )
| A. | 氯化氢溶于水 | B. | 氯化钠溶于水 | C. | 干冰的升华 | D. | 氯化钠熔化 |
20. 凡有一个手性碳原子的物质具有光学活性,如图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )
凡有一个手性碳原子的物质具有光学活性,如图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )
 凡有一个手性碳原子的物质具有光学活性,如图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )
凡有一个手性碳原子的物质具有光学活性,如图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )| A. | 与乙酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 与银氨溶液作用发生银镜反应 | D. | 催化剂作用下与H2作用 |
7.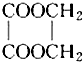 以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
①氧化反应 ②消去反应 ③加成反应 ④酯化反应 ⑤水解反应 ⑥加聚反应.
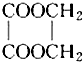 以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )①氧化反应 ②消去反应 ③加成反应 ④酯化反应 ⑤水解反应 ⑥加聚反应.
| A. | ②③①⑤④ | B. | ②③⑤④① | C. | ②③⑤①④ | D. | ②③⑤①⑥ |
17.下列选项中,符合如图所示关系的是( )


| A. | 一定状况下,气体摩尔体积(y)与该气体的物质的量(x)的关系 | |
| B. | 铁在氯气中燃烧,生成FeCl3的物质的量(y)与消耗氯气的物质的量(x)的关系 | |
| C. | 将铁在常温下放入浓硫酸中,生成气体的物质的量(y)与消耗浓硫酸的物质的量(x)的关系 | |
| D. | H2SO4溶液的物质的量浓度(y)与其质量分数(x) 的关系 |
4.下列反应,属于氧化还原反应的是( )
| A. | 2Na2O2+2CO2=2Na2CO3+O2 | B. | Na2O+CO2=Na2CO3 | ||
| C. | 2NaOH+CO2=Na2CO3+H2O | D. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O |
1.下列有关能量的判断或表示方法正确的是( )
| A. | 从C(s,石墨)═C(s,金刚石)△H=+1.9 kJ•mol-1,可知石墨比金刚石更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 | |
| C. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液充分混合反应,放出的热量等于57.3 kJ | |
| D. | 2g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ•mol-1 |
2.某烃的结构简式为: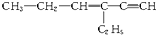 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
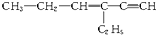 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )| A. | 4,3,5 | B. | 4,3,6 | C. | 2,5,4 | D. | 4,6,4 |