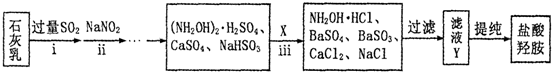
题目内容
11.电解精炼粗铜时,下列叙述不正确的是( )| A. | 与电源正极相连的电极是粗铜板 | B. | 阴极发生反应:Cu2++2e-═Cu | ||
| C. | 电解池的阳极材料为粗铜 | D. | 粗铜板上发生还原反应 |
分析 电镀法精炼铜时,粗铜为阳极,精铜为阴极,阳极材料是粗铜,阳极上金属失电子变成离子进入溶液,Cu-2e-=Cu2+,比金属铜活泼的金属锌、铁、镍会先于金属铜失电子,比金属铜活泼性差的Pt、Ag等固体会沉积下来形成阳极泥,根据电解原理来回答.
解答 解:A、电解法精炼铜时,粗铜为阳极,精铜为阴极,则与电源正极相连的电极是粗铜板,故A正确;
B、电解时,阴极上铜离子得电子生成Cu,则阴极发生的反应为:Cu2++2e-=Cu,故B正确;
C、电解法精炼铜时,粗铜为阳极,精铜为阴极,故C正确;
D、电解法精炼铜时,粗铜为阳极,阳极上Cu失电子发生氧化反应,故D错误.
故选D.
点评 本题考查学生电解精炼铜的工作原理,侧重于对电解原理的应用、阴阳极的判断、电极方程式的书写等知识的考查,注意教材知识的梳理和记忆,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列各组性质比较中,不正确的是( )
| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 碱性:KOH>NaOH>LiOH | ||
| C. | 单质的氧化性:F2<Cl2<Br2<I2 | D. | 单质的还原性:Al<Mg<Na |
2.下列表示物质或微粒的化学用语或模型正确的是( )
| A. | N2的结构式:N-N | B. | Mg2+的结构示意图: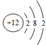 | ||
| C. | -CH3(甲基)的电子式: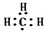 | D. | CO2分子的比例模型: |
6.有分子式为C10H20O2的酯A,在酸性条件下水解生成有机物C和D,且C在一定条件下可转化成D,则A的可能结构有( )
| A. | 4种 | B. | 8种 | C. | 16种 | D. | 40种 |
3.下列物质,既能与盐酸反应又能与氢氧化钠溶液反应的是( )
| A. | AlCl3 | B. | Al(OH)3 | C. | KOH | D. | HCl |
1.如图是某有机物核磁共振氢谱图,但该物质可能是( )
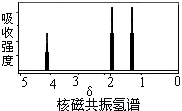

| A. | CH3COOCH2CH3 | B. | CH3CH=CHCH3 | C. | CH3CH2CH3 | D. | CH3CHOHCH3 |
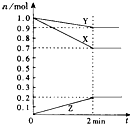 (1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:3X+Y
(1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:3X+Y 2Z
2Z .
. ;
;