6.下列化学用语正确的是( )
| A. | 原子核内有8个中子的氧原子:18O | B. | Na2O的电子式: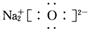 | ||
| C. | CO2的比例模型: | D. | F一的结构示意图: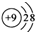 |
4.物质结构决定性质,深入研究物质的微观结构,有利于理解物质变化的本质.请回答下列问题:
(1)C、Si、N的电负性由大到小的顺序是N>C>Si;C、N、O、F的第一电离能由大到小的顺序是F>N>O>C.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+有颜色(填“无”或“有”).
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
(1)C、Si、N的电负性由大到小的顺序是N>C>Si;C、N、O、F的第一电离能由大到小的顺序是F>N>O>C.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
2.分子间存在着分子作用间力的实验事实是( )
| A. | 食盐、氯化钾等晶体易溶于水 | |
| B. | 氯气在加压、降温时会变成液氯或固氯 | |
| C. | 融化的铁水降温可铸成铁锭 | |
| D. | 金刚石有相当大的硬度 |
1.关于氢键,下列说法正确的是( )
| A. | 水在结冰时体积膨胀,是由于水分子之间存在氢键 | |
| B. | 由于N、O、F的第一电离能较大,所以NH3、H2O、HF分子间可以形成氢键 | |
| C. | 只要有氢键,物质的熔点和沸点就会升高 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
20.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实 验 事 实 | 理 论 解 释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子半径小于氧原子 |
| B | 干冰的熔沸点低 | 干冰为分子晶体 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
19.下列化合物中只有离子键的是( )
| A. | MgCl2 | B. | Na2O2 | C. | KHSO4 | D. | NH4Cl |
18.下列表述正确的是( )
0 167784 167792 167798 167802 167808 167810 167814 167820 167822 167828 167834 167838 167840 167844 167850 167852 167858 167862 167864 167868 167870 167874 167876 167878 167879 167880 167882 167883 167884 167886 167888 167892 167894 167898 167900 167904 167910 167912 167918 167922 167924 167928 167934 167940 167942 167948 167952 167954 167960 167964 167970 167978 203614
| A. | CH3F的电子式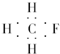 | B. | Na2S的电子式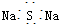 | C. | 氢氧根的电子式 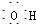 | D. | 次氯酸的电子式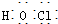 |
 ,它极易溶于水,是因为它与水分子间容易形成氢键,它与W元素的氢化物反应形成的化合物属于离子晶体;
,它极易溶于水,是因为它与水分子间容易形成氢键,它与W元素的氢化物反应形成的化合物属于离子晶体;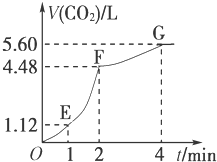 向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)请回答下列问题:
向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)请回答下列问题: