题目内容
4.物质结构决定性质,深入研究物质的微观结构,有利于理解物质变化的本质.请回答下列问题:(1)C、Si、N的电负性由大到小的顺序是N>C>Si;C、N、O、F的第一电离能由大到小的顺序是F>N>O>C.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
分析 (1)同周期随原子序数增大,电负性增大,同主族自上而下电负性减小;
同周期随原子序数增大,第一电离能呈增大趋势,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(2)A由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,根据原子核外电子排布规律书写;
(3)根据核外电子排布规律,书写Mn2+的核外电子排布式,据此结合题目信息“d轨道为d0或d10排布时,无颜色,为d1~d9排布时,有颜色”判断;
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,核外电子排布式为1s22s22p63s23p5.
解答 解:(1)同周期随原子序数增大,电负性增大,同主族自上而下电负性减小,故电负性:N>C>Si,
同周期随原子序数增大,第一电离能呈增大趋势,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能为:F>N>O>C,
故答案为:N>C>Si;F>N>O>C;
(2)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,原子的电子排布式为1s22s22p63s2,
故答案为:1s22s22p63s2;
(3)Mn2+的核外电子排布式为1s22s22p63s23p63d8,d能级为排满电子,故,[Mn(H2O6)]2+ 有颜色,故答案为:有;
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,核外电子排布式为1s22s22p63s23p5,故L为Cl元素,故答案为:Cl.
点评 本题考查元素周期律、核外电子排布等,注意(2)中电离能与化合价的关系,注意同周期第一电离能异常情况.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案| 50mL 盐酸 | 50mL 盐酸 | 50mL 盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2) | 2.24L | 3.36L | 3.36L |
| A. | 盐酸的物质的量浓度为5.0mol•L-1 | |
| B. | 根据表中数据计算出混合物中NaHCO3的质量分数:0.457 | |
| C. | 加入固体混合物中NaHCO3和KHCO3的质量比为1:1 | |
| D. | 加入15.7g混合物时盐酸足量 |
| A. | 高强度、质量轻 | B. | 耐热、抗高温 | C. | 耐腐蚀、稳定性好 | D. | 导电、导热性好 |
| A. | 预防H7N9流感病毒的措施之一是高温消毒餐具等生活日用品 | |
| B. | 大气中直径小于或等于2.5微米的颗粒物(PM2.5)会造成空气污染,应加强监测和治理 | |
| C. | 我国京津冀等城市实施SO2、CO2、NO2、N2等大气污染物排放限制 | |
| D. | 积极推广太阳能、风能、地热能等新能源的使用,减少化石燃料的使用,有效降低PM2.5对环境的污染 |
| A. | MgCl2 | B. | Na2O2 | C. | KHSO4 | D. | NH4Cl |
| A. | 碳和硅都是ⅣA的元素,CO2和SiO2属于同种类型的晶体 | |
| B. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| C. | H2O、H2S、H2Se的分子结构和组成相似,随着相对分子质量的增加,它们的熔点依次升高 | |
| D. | Cs和Ba分别位于第6周期ⅠA和ⅡA族,碱性:CsOH>Ba(OH)2 |
| A. | NH4+和CH4属于等电子体,立体构型都是正四面体 | |
| B. | 主族元素的原子核外电子最后填入的能级是s能级或p能级 | |
| C. | BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 | |
| D. | 向盛有硫酸铜溶液的试管里加入过量氨水,将得到蓝色的氢氧化铜沉淀 |

| A. | 遇FeCl3溶液呈紫色,且该物质与苯酚属于同系物 | |
| B. | 滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2的物质的量分别为6mol和7mol | |
| D. | 该分子中的所有碳原子可能共平面 |
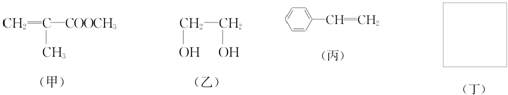
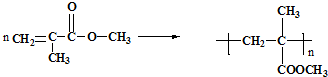
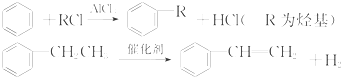 利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$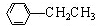 +HCl.
+HCl.