题目内容
17.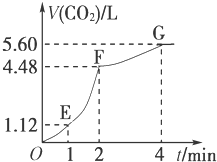 向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)请回答下列问题:
向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)请回答下列问题:(1)设OE段的反应速率为v1,EF段的反应速率为v2,FG段的反应速率为v3,则速率从大到小的顺序为v2>v1>v3.(用v1、v2、v3表示)
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是ACE(填字母).
A.蒸馏水 B.氯化钾固体 C.氯化钠溶液
D.浓盐酸 E.降低温度 F.减少CaCO3
(3)若反应过程中溶液体积的变化忽略不计,计算FG段用盐酸表示的化学反应速率是多少?(写出计算过程)
分析 (1)单位时间内生成气体的体积越大,反应速率越大;
(2)减缓反应速率,应减小溶液的浓度;
(3)据v(HCl)=$\frac{△c}{△t}$计算.
解答 解:(1)从图象可知,单位时间内生成的气体EF段>OE段>FG段,单位时间内生成气体的体积越大,反应速率越大,则v2>v1>v3,故答案为:v2>v1>v3;
(2)A、加入蒸馏水,溶液的浓度减小,反应速率减小,故A正确;
B、氯化钾固体对溶液的浓度无影响,且KCl不参加反应,所以速率不变,故B错误;
C、加入氯化钠溶液,减小盐酸的浓度,反应速率减小,故C正确;
D、加入浓盐酸,盐酸的浓度增大,反应速率增大,故D错误;
E.降低温度,反应速率减小,故E正确;
F、减少CaCO3固体的量不会引起反应速率的变化,故F错误;
故答案为:ACE;
(3)FG段生成二氧化碳的物质的量为:$\frac{5.60L-4.48L}{22.4L/mol}$=0.05mol,所以参加反应的盐酸的物质的量为0.1mol,
FG段用盐酸表示的反应速率为
v(HCl)=$\frac{\frac{0.1mol}{0.2L}}{2min}$=0.25 mol•L-1•min-1,
故答案为:v(HCl)=$\frac{\frac{0.1mol}{0.2L}}{2min}$=0.25 mol•L-1•min-1.
点评 本题考查化学反应速率计算、比较以及影响因素的判断,题目难度不大,注意计算的方法和影响因素有哪些.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
8.能说明氧的非金属性比硫强的是( )
①氢硫酸溶液在空气中置露会变浑浊
②在通常状况下,氧单质的熔沸点比硫单质低
③硫化氢在加热的条件下既可分解成氢气和硫,而水在高温时很少分解
④铜与硫反应生成硫化亚铜,与氧气反应生成氧化铜.
①氢硫酸溶液在空气中置露会变浑浊
②在通常状况下,氧单质的熔沸点比硫单质低
③硫化氢在加热的条件下既可分解成氢气和硫,而水在高温时很少分解
④铜与硫反应生成硫化亚铜,与氧气反应生成氧化铜.
| A. | ①③④ | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
5.钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )


| A. | 该晶体属于离子晶体 | |
| B. | 晶体的化学式为BaO2,所以晶体中阴阳离子个数比1:2 | |
| C. | 若将晶胞中阴阳离子位置互换,其图形依然可以看作该晶体的晶胞结构图 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有12个 |
12.化学与社会、科学、技术、环境密切相关.下列说法不正确的是( )
| A. | 预防H7N9流感病毒的措施之一是高温消毒餐具等生活日用品 | |
| B. | 大气中直径小于或等于2.5微米的颗粒物(PM2.5)会造成空气污染,应加强监测和治理 | |
| C. | 我国京津冀等城市实施SO2、CO2、NO2、N2等大气污染物排放限制 | |
| D. | 积极推广太阳能、风能、地热能等新能源的使用,减少化石燃料的使用,有效降低PM2.5对环境的污染 |
2.分子间存在着分子作用间力的实验事实是( )
| A. | 食盐、氯化钾等晶体易溶于水 | |
| B. | 氯气在加压、降温时会变成液氯或固氯 | |
| C. | 融化的铁水降温可铸成铁锭 | |
| D. | 金刚石有相当大的硬度 |
9.下列说法合理的是( )
| A. | 碳和硅都是ⅣA的元素,CO2和SiO2属于同种类型的晶体 | |
| B. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| C. | H2O、H2S、H2Se的分子结构和组成相似,随着相对分子质量的增加,它们的熔点依次升高 | |
| D. | Cs和Ba分别位于第6周期ⅠA和ⅡA族,碱性:CsOH>Ba(OH)2 |
6.镭是元素周期中第七周期ⅡA族元素,下列关于镭的性质的描述中,不正确的是( )
| A. | 在化合物中呈+2价 | B. | 氢氧化物呈两性 | ||
| C. | 硫酸盐难溶于水 | D. | 镭比钙的金属性强 |
7.以下这些结构简式,书写规范正确的是( )
| A. | 乙醛:CH3COH | B. | 新戊烷:(CH3)4C | C. | 聚氯乙烯: | D. | 三硝基甲苯: |