题目内容
6.下列化学用语正确的是( )| A. | 原子核内有8个中子的氧原子:18O | B. | Na2O的电子式: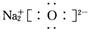 | ||
| C. | CO2的比例模型: | D. | F一的结构示意图: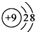 |
分析 A、氧元素的质子数为8,中子数为8的氧原子的质量数为16,不是18;
B、氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,且离子个数不能合并;
C、碳原子半径比氧原子半径大;
D、F原子序数为9,得到1个电子形成最外层8个电子的稳定结构.
解答 解:A、含有8个中子的氧原子的质量数为16,该氧原子可以表示为:816O,故A错误;
B、氧化钠为离子化合物,钠离子直接用离子符号表示,阳离子需要标出最外层电子及所带的电荷,氧化钠的电子式为: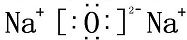 ,故B错误;
,故B错误;
C、碳原子半径比氧原子半径大,但比例模型中C原子的比较比O原子半径小,正确应为: ,故C错误;
,故C错误;
D、F原子序数为9,得到1个电子形成最外层8个电子的稳定结构,离子结构示意图为: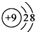 ,故D正确,故选D.
,故D正确,故选D.
点评 本题考查了电子式、离子结构示意图、化学式等表示方法的判断,题目难度中等,注意掌握电子式、原子结构示意图等化学用语的概念及表示方法,明确离子化合物与共价化合物的电子式区别

练习册系列答案
相关题目
17.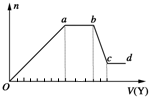 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂的体积(V)的关系如图所示.(铵根和偏铝酸根不能共存)
(1)若Y是盐酸,则X中一定含有的离子是SiO32-、AlO2-、CO32-、Na+,bc段发生反应的离子方程式为Al(OH)3+3H+═Al3++3H2O
(2)若Y是NaOH溶液,则X中一定含有的阴离子是Cl-,假设X溶液只含这几种离子,则溶液中各离子的物质的量之比为n(Al3+):n(Mg2+):n(NH4+):n(Cl-)=2:1:3:11,ab段发生反应的离子方程式为NH4++OH-═NH3•H2O.
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(1)若Y是盐酸,则X中一定含有的离子是SiO32-、AlO2-、CO32-、Na+,bc段发生反应的离子方程式为Al(OH)3+3H+═Al3++3H2O
(2)若Y是NaOH溶液,则X中一定含有的阴离子是Cl-,假设X溶液只含这几种离子,则溶液中各离子的物质的量之比为n(Al3+):n(Mg2+):n(NH4+):n(Cl-)=2:1:3:11,ab段发生反应的离子方程式为NH4++OH-═NH3•H2O.
14.炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)?2CO(g)△H=Q kJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )
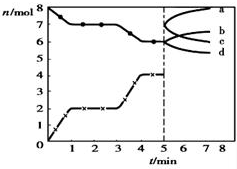

| A. | 1~3min时,v(CO)=v(CO2) | |
| B. | 当容器内的压强不变时,该反应一定达到平衡状态,且$\frac{P(平衡)}{P(开始)}<1$ | |
| C. | 若3min时温度由T1升高到T2,则Q>O,且$\frac{K({T}_{2})}{K({T}_{1})}$=4.7 | |
| D. | 5min时再充入一定量的CO,c、b曲线分别表示n(CO)、n(CO2)的变化 |
1.关于氢键,下列说法正确的是( )
| A. | 水在结冰时体积膨胀,是由于水分子之间存在氢键 | |
| B. | 由于N、O、F的第一电离能较大,所以NH3、H2O、HF分子间可以形成氢键 | |
| C. | 只要有氢键,物质的熔点和沸点就会升高 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
15.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石.已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是( )
| A. | 金刚石与石墨互为同位素 | |
| B. | 相同物质的量的石墨具有的能量比金刚石具有的能量高 | |
| C. | 金刚石不如石墨稳定 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量多 |
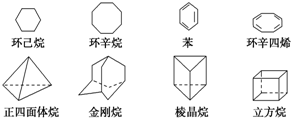 下列是八种环状的烃类物质:
下列是八种环状的烃类物质: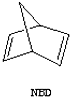 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$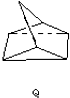 △H=+88.62kJ/mol
△H=+88.62kJ/mol .若用氯原子取代NBD分子中的一个H原子,可得到的同分异构体共有3种.
.若用氯原子取代NBD分子中的一个H原子,可得到的同分异构体共有3种.