6.草酸(H2C3O4)是一种重要的有机化工原料,为探究草酸的制取和草酸的性质,进行如下实验.
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示: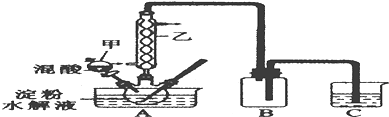
①一定量的淀粉水解液加入三劲烧瓶中
②控制反应温度55~60℃,边搅拌边缓慢滴加一定量的混合酸(65%的H2SO4与98%的H2SO4的质量比2:1.25)
③反应3小时,冷却,有随后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:
C8H12O6+12HNO3═3H3C2O4+9NO2↑+3NO↑+9H2O
(1)装置B的作用是安全瓶(或防止C中液体倒吸进A中)
(2)如何检验该装置的气密性:关闭分液漏斗甲的活塞,将C中导管口插入烧杯中的水中,用酒精灯稍微加热三颈烧瓶,若导管口产生气泡,冷却后,导管口产生一段水柱,则气密性良好
(3)要控制反应温度55~60℃,应选择加热的方式是水浴加热,C装置中应加入NaOH溶液.
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(4)向草酸溶液中逐滴加硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:5H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快,为探究其原因,同学们做了如下对比实验:
由此你认为溶液褪色总是先慢后快的原因是生成的Mn2+对此反应起催化剂的作用
(6)为测定上述实验中得到草酸的纯度,取5.0g该草酸样品,配制成250mL溶液,然后取25.00mL此溶液溶于锥形瓶中,将0.10mol/L酸性KMnO4溶液装在酸式滴定管(填仪器名称)中进行滴定,达到滴定终点时的现象是溶液由无色变为紫色,且半分钟不褪色.
若消耗酸性KMnO4溶液体积为20.00mL,则该草酸样品的纯度为90%.
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示:

①一定量的淀粉水解液加入三劲烧瓶中
②控制反应温度55~60℃,边搅拌边缓慢滴加一定量的混合酸(65%的H2SO4与98%的H2SO4的质量比2:1.25)
③反应3小时,冷却,有随后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:
C8H12O6+12HNO3═3H3C2O4+9NO2↑+3NO↑+9H2O
(1)装置B的作用是安全瓶(或防止C中液体倒吸进A中)
(2)如何检验该装置的气密性:关闭分液漏斗甲的活塞,将C中导管口插入烧杯中的水中,用酒精灯稍微加热三颈烧瓶,若导管口产生气泡,冷却后,导管口产生一段水柱,则气密性良好
(3)要控制反应温度55~60℃,应选择加热的方式是水浴加热,C装置中应加入NaOH溶液.
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(4)向草酸溶液中逐滴加硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:5H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快,为探究其原因,同学们做了如下对比实验:
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(g) | ||
| C(mo•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
(6)为测定上述实验中得到草酸的纯度,取5.0g该草酸样品,配制成250mL溶液,然后取25.00mL此溶液溶于锥形瓶中,将0.10mol/L酸性KMnO4溶液装在酸式滴定管(填仪器名称)中进行滴定,达到滴定终点时的现象是溶液由无色变为紫色,且半分钟不褪色.
若消耗酸性KMnO4溶液体积为20.00mL,则该草酸样品的纯度为90%.
1.用已知物质的量浓度的酸测定未知物质的量浓度的碱时,会导致待测碱液的物质的量浓度偏低的操作是( )
①酸式滴定管在滴定前未将液面调至“0”刻度,而调在“2.40”
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③滴定前酸式滴定管尖嘴部分未充满溶液,滴定后充满溶液
④滴定中不慎将锥形瓶内液体摇出瓶外
⑤滴定达终点时,视线高于滴定管内液面凹面的最低点.
①酸式滴定管在滴定前未将液面调至“0”刻度,而调在“2.40”
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③滴定前酸式滴定管尖嘴部分未充满溶液,滴定后充满溶液
④滴定中不慎将锥形瓶内液体摇出瓶外
⑤滴定达终点时,视线高于滴定管内液面凹面的最低点.
| A. | ①②④ | B. | ②③④ | C. | ②③⑤ | D. | ②④⑤ |
19.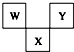 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )
0 167778 167786 167792 167796 167802 167804 167808 167814 167816 167822 167828 167832 167834 167838 167844 167846 167852 167856 167858 167862 167864 167868 167870 167872 167873 167874 167876 167877 167878 167880 167882 167886 167888 167892 167894 167898 167904 167906 167912 167916 167918 167922 167928 167934 167936 167942 167946 167948 167954 167958 167964 167972 203614
 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )| A. | 三种元素的原子半径的大小顺序是W<Y<X | |
| B. | W最高价氧化物对应水化物具有强酸性,气态氢化物的水溶液具有弱碱性 | |
| C. | X元素的氧化物、氢化物的水溶液都呈酸性 | |
| D. | Y元素的单质是非金属单质中唯一能跟水发生剧烈反应的单质 |
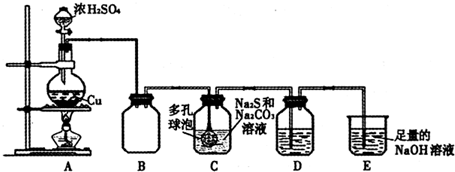

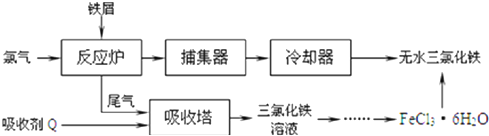

 .
. ,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑
,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑