题目内容
3.硫酸铁铵[aFe2(SO4)3•b(NH4)2SO4•cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等.某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵.
请回答下列问题:
(1)硫酸亚铁溶液加 H2SO4酸化的主要目的是增大溶液中SO42-浓度,将Ca2+转化为沉淀,同时抑制Fe2+、Fe3+水解,滤渣A的主要成分是CaSO4.
(2)下列物质中最适合的氧化剂B是b;反应的离子方程式H2O2+2Fe2++2H+=2Fe2++2H2O.
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲冷却结晶,乙常温晾干.
(4)检验硫酸铁铵中NH4+的方法是向试管中加入少量样品和氢氧化钠溶液加热,在试管口用湿润的红色石蕊试纸检验若变蓝,则含NH4+.
(5)称取14g 所得样品,将其溶于水配制成100mL 溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤得 2.14g沉淀;向另一份溶液中加入 0.05mol Ba (NO3)2溶液,恰好完全反应.则该硫酸铁铵的化学式为Fe2(SO4)3•2(NH4)2SO4•2H2O.
分析 原料中加入硫酸酸化,增大溶液中SO42-浓度,将Ca2+转化为沉淀,可以抑制Fe2+、Fe3+水解,过滤分离,减压过滤后加入B物质,目的是将亚铁离子氧化为铁离子,且不能引入新杂质,最适合的氧化剂为过氧化氢,硫酸铁与硫酸铵在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经过常温晾晒可到纯净的硫酸铁铵.
(4)在试管中加入少量样品和氢氧化钠固体加热,在试管口用湿润的红色石蕊试纸检验;
(5)14g所得样品配成溶液,分成两等份,其中一份加入氢氧化钠得到2.14g沉淀为氢氧化铁,根据n=mMmM计算氢氧化铁的物质的量;另一份溶液中加入0.05mol Ba (NO3)2溶液,恰好完全反应生成硫酸钡沉淀,根据钡离子可知溶液中硫酸根离子物质的量,根据铁离子、硫酸根守恒计算Fe2(SO4)3、(NH4)2SO4的物质的量,再计算每一份晶体中结晶水的质量,进而计算结晶水的物质的量确定化学式.
解答 解:原料中加入硫酸酸化,增大溶液中SO42-浓度,将Ca2+转化为沉淀,可以抑制Fe2+、Fe3+水解,过滤分离,减压过滤后加入B物质,目的是将亚铁离子氧化为铁离子,且不能引入新杂质,最适合的氧化剂为过氧化氢,硫酸铁与硫酸铵在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经过常温晾晒可到纯净的硫酸铁铵.
(1)硫酸亚铁溶液加 H2SO4酸化,增大溶液中SO42-浓度,将Ca2+转化为沉淀,同时抑制Fe2+、Fe3+水解,滤渣A的成分为:CaSO4,
故答案为:增大溶液中SO42-浓度,将Ca2+转化为沉淀,同时抑制Fe2+、Fe3+水解;CaSO4;
(2)加入B物质,目的是将亚铁离子氧化为铁离子,H2O2的还原产物是水,是绿色氧化剂,而别的试剂都会引入新的杂质,故试剂B选过氧化氢,反应离子方程式为:H2O2+2Fe2++2H+=2Fe2++2H2O,
故答案为:b;H2O2+2Fe2++2H+=2Fe2++2H2O;
(3)根据流程从溶液中得到沉淀的方法是冷却结晶,再常温晾干即可,温度不能过高,防止分解,故甲为冷却结晶,乙为常温晾干,
故答案为:冷却结晶;常温晾干;
(4)在试管中加入少量样品和氢氧化钠固体加热,在试管口用湿润的红色石蕊试纸检验,看到试纸变成蓝色,则证明原溶液中含有氨根离子,
故答案为:向试管中加入少量样品和氢氧化钠溶液加热,在试管口用湿润的红色石蕊试纸检验若变蓝,则含NH4+;
(5)14g所得样品配成溶液,分成两等份,其中一份加入氢氧化钠得到2.14g沉淀为氢氧化铁,所以铁的物质的量是2.14g107g/mol2.14g107g/mol=0.02mol;向另一份溶液中加入0.05mol Ba (NO3)2溶液,恰好完全反应生成硫酸钡沉淀.因此溶液中n(SO42-)=0.05mol,故每一份中含有的Fe2(SO4)3为0.02mol20.02mol2=0.01mol,(NH4)2SO4为0.05mol-0.01mol×3=0.02mol,每一份中结晶水的质量为:7.00g-(0.01mol×400g/mol+0.02mol×132g/mol)=0.36g,n(H2O)=0.36g18g/mol0.36g18g/mol=0.02mol,因此该硫酸铁铵的化学式为:Fe2(SO4)3•2(NH4)2SO4•2H2O,
故答案为:Fe2(SO4)3•2(NH4)2SO4•2H2O.
点评 本题考查物质制备实验,涉及物质的分离提纯、对方案的分析评价、物质组成的沉淀等,侧重于学生的分析能力、实验能力和计算能力的考查,明确工艺流程原理是解题关键,难度中等.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
| A. | 用浓硝酸与Cu反应制取NO2 | B. | 用浓盐酸和MnO2反应制取Cl2 | ||
| C. | 用H2O2溶液和MnO2反应制取O2 | D. | 用NH4Cl和Ca(OH)2反应制取NH3 |
| 实验目的 | 实验操作 | |
| A | 验证乙炔能被酸性高锰酸 钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性 高锰酸钾溶液,观察溶液是否褪色 |
| B | 验证苯和液溴在FeBr3的 催化下发生取代反应 | 将反应产生的混合气体通入AgNO3溶液上方, 观察是否有淡黄色沉淀生成 |
| C | 除去乙酸乙酯中混有的少 量乙酸 | 加入足量饱和Na2CO3溶液,振荡,静置,分液, 取出上层液体 |
| D | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝 酸银溶液,观察是否出现淡黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |

| A. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是氯气 | |
| B. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| C. | 若D为NaCl,且A可与C反应生成B,则E一定是CO2 | |
| D. | 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C |
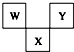 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )| A. | 三种元素的原子半径的大小顺序是W<Y<X | |
| B. | W最高价氧化物对应水化物具有强酸性,气态氢化物的水溶液具有弱碱性 | |
| C. | X元素的氧化物、氢化物的水溶液都呈酸性 | |
| D. | Y元素的单质是非金属单质中唯一能跟水发生剧烈反应的单质 |
| A. | 未用标准液润洗碱式滴定管 | |
| B. | 滴定终点读数时,俯视滴定管的刻度 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用高锰酸钾酸性溶液可区分乙烷和乙烯 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用裂化汽油从碘水中提取碘 |


