17. (1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:
(1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:
$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
该反应的平衡常数表达式K=$\frac{[C{O}_{2}]}{[CO]}$,△H<0(填“>”、“<”或“=”);
(2)工业上CO 也用于合成甲醇:
CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ•mol-1.一定压强下,向容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示.
①p1小于p2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=$(\frac{V}{a})^{2}$(mol•L-1)-2;
③保持其它条件不变,下列措施中能够增大上述合成甲醇反应的反应速率、且能提高CO转化率的是cd.(填字母).
a.使用高效催化剂 b.降低反应温度 c.通入H2d.再增加a mol CO和2a molH2 e.不断将CH3OH从反应混合物中分离出来.
 (1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:
(1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)工业上CO 也用于合成甲醇:
CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ•mol-1.一定压强下,向容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示.
①p1小于p2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=$(\frac{V}{a})^{2}$(mol•L-1)-2;
③保持其它条件不变,下列措施中能够增大上述合成甲醇反应的反应速率、且能提高CO转化率的是cd.(填字母).
a.使用高效催化剂 b.降低反应温度 c.通入H2d.再增加a mol CO和2a molH2 e.不断将CH3OH从反应混合物中分离出来.
15.高温下,某反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| A. | 该反应的化学方程式为CO+H2O$\frac{\underline{\;催化剂\;}}{高温}$CO2+H2 | |
| B. | 该反应的焓变为正值 | |
| C. | 恒温恒容下,充入氮气,平衡右移 | |
| D. | 升高温度,逆反应速率减小 |
14.下列图示与对应的叙述一定正确的是( )


| A. | 图1所示反应:X(g)+2Y(g)?3Z(g),b曲线表示的一定是增大压强 | |
| B. | 图2表示催化剂能改变化学反应的焓变 | |
| C. | 图3表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)═N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 图3表示向稀CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
13.下列不能用勒夏特列原理解释的是( )
| A. | 500℃时比室温更有利于合成氨的反应 | |
| B. | 红棕色的NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往加入过量的空气 | |
| D. | 实验室中常用排饱和食盐水的方法收集氯气 |
12.下列说法正确的是( )
| A. | 室温时,在水电离出c(H+)=1.0×10-12mol•L-1的溶液中,K+、Na+、HCO3-、Cl-一定能大量共存 | |
| B. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 常温下,pH=2的醋酸溶液中所含有的H+数为0.01 NA | |
| D. | 将92 g N2O4晶体放入容器中,恢复到常温常压时,所含气体分子数大于NA |
11.下列实验或操作能实现的是( )


| A. | 用25 mL酸式滴定管量取20.00 mL KMnO4溶液 | |
| B. | 图1可表示0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1CH3COOH溶液所得到的滴定曲线 | |
| C. | 做导电实验时,强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | 其它条件相同下,图2可探究Fe3+和Cu2+对H2O2分解反应的催化效果 |
10.下列说法中不正确的是( )
| A. | 一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0 | |
| B. | 使用催化剂,降低反应的活化能,增大单位体积内活化分子百分数,反应速率增大 | |
| C. | SO2(g)+2CO(g)?2CO2(g)+S(l)达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高 | |
| D. | 恒温恒压下,向一平衡体系中通入惰性气体,反应速率减小 |
9.下列一定能说明HNO2是弱电解质的是( )
①相同条件下,同浓度的HNO2的导电性比盐酸弱 ②用HNO2作导电实验,灯泡很暗
③HNO2能使石蕊试液变红 ④0.1mol/L HNO2溶液的c(H+)=10-2mol/L.
0 167765 167773 167779 167783 167789 167791 167795 167801 167803 167809 167815 167819 167821 167825 167831 167833 167839 167843 167845 167849 167851 167855 167857 167859 167860 167861 167863 167864 167865 167867 167869 167873 167875 167879 167881 167885 167891 167893 167899 167903 167905 167909 167915 167921 167923 167929 167933 167935 167941 167945 167951 167959 203614
①相同条件下,同浓度的HNO2的导电性比盐酸弱 ②用HNO2作导电实验,灯泡很暗
③HNO2能使石蕊试液变红 ④0.1mol/L HNO2溶液的c(H+)=10-2mol/L.
| A. | ①②③ | B. | ②③④ | C. | ①④ | D. | ②④ |
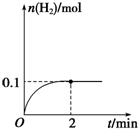 一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.
一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.