题目内容
10.下列说法中不正确的是( )| A. | 一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0 | |
| B. | 使用催化剂,降低反应的活化能,增大单位体积内活化分子百分数,反应速率增大 | |
| C. | SO2(g)+2CO(g)?2CO2(g)+S(l)达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高 | |
| D. | 恒温恒压下,向一平衡体系中通入惰性气体,反应速率减小 |
分析 A、反应是否自发进行,是根据焓变、熵变和温度判断依据进行分析,若△H-T△S<0,反应自发进行;若△H-T△S>0,则反应非自发进行;
B、催化剂降低反应的活化能;
C、固体和纯液体的多少对反应速率无影响;
D、压强不变充入惰性气体,参与反应的各气体浓度减小.
解答 解:A、该反应的△S<0,若△H-T△S<0,则△H必须小于0,故A正确;
B、催化剂降低反应的活化能能增大单位体积内活化分子百分数,反应速率加快,故B正确;
C、反应达到平衡状态后,分离出S,反应速率不变,故C错误;
D、压强不变充入惰性气体,参与反应的各气体浓度减小,反应速率减慢,故D正确;
故选C.
点评 本题考查外界条件对反应速率的影响,题目难度不大,注意浓度、压强、温度以及催化剂对活化分子的影响的不同.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
1.下列各组物质的性质及粒子的性质变化正确的是( )
| A. | 稳定性H2S>HCl>HBr>HI | B. | 酸性HF>HCl>HBr>HI | ||
| C. | 离子半径K+>Cl->S2->S | D. | 酸性HClO4>H2SO4>H2CO3>HClO |
18.等质量的铜片在酒精灯上加热后,分别插入下列液体中,放置片刻后取出,铜片质量增加的是( )
| A. | 盐酸 | B. | 无水乙醇 | C. | 稀硝酸 | D. | NaOH溶液 |
5.下列物质充分反应后,滴入KSCN溶液,显红色的是( )
| A. | FeO+HNO3(溶液) | B. | 过量铁+稀硫酸 | ||
| C. | FeCl3(溶液)+过量铁 | D. | Fe+CuSO4(溶液) |
15.高温下,某反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| A. | 该反应的化学方程式为CO+H2O$\frac{\underline{\;催化剂\;}}{高温}$CO2+H2 | |
| B. | 该反应的焓变为正值 | |
| C. | 恒温恒容下,充入氮气,平衡右移 | |
| D. | 升高温度,逆反应速率减小 |
2.下列气体的收集用错装置的是( )
| A. |  Cl2的收集 | B. |  HCl的收集 | C. |  NH3的收集 | D. |  NO的收集 |
20.下列物质中都存在离子键、极性键和配位键的是( )
| A. | 氢氧化钠、过氧化钠、硫酸四氨合铜[Cu(NH3)4]SO4、氢化钠 | |
| B. | 硝酸铵、氢化铵、氢氧化二氨合银[Ag(NH3)2]OH、硫酸铵 | |
| C. | 硫酸、氢氧化钠、氮化钙、氢氧化钡 | |
| D. | 氯化铵、氢氧化钠、双氧水、过氧化钙 |

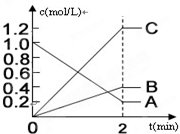 (1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为PbO2+Pb+2H2SO4═2PbSO4+2H2O,据此判断:
(1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为PbO2+Pb+2H2SO4═2PbSO4+2H2O,据此判断: