题目内容
8.向一定质量的碳酸钙中加入100ml稀盐酸(过量),完全反应后,产生的二氧化碳气体在标准状况下的体积是1.12L.请计算:(1)碳酸钙的质量;
(2)生成的CaCl2溶液的物质的量浓度(假设反应前后溶液体积不变).
分析 (1)根据碳酸钙中加入100ml稀盐酸(过量),反应方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑,根据生成二氧化碳的体积计算消耗碳酸钙的质量;
(2)根据碳酸钙计算氯化钙的物质的量,再根据C=$\frac{n}{V}$计算浓度.
解答 解:(1)根据碳酸钙中加入100ml稀盐酸(过量),反应方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑,
碳原子守恒得CaCO3----CO2,设碳酸钙的质量为x,
CaCO3----CO2
100g 22.4L
x 1.12L
100g:22.4L=x:1.12L
解得x=5g,
答:碳酸钙的质量为5g;
(2)根据钙原子守恒得CaCO3----CaCl2,氯化钙的物质的量=$\frac{5.0g}{100g}$=0.05mol,氯化钙的物质的量浓度=$\frac{0.05mol}{0.1L}$=0.5mol/L,
答:所得溶液中氯化钙的物质的量浓度为0.5mol/L.
点评 本题考查了物质的量的有关计算,根据溶液中物质之间的关系式进行计算,难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
19.在一个体积不变的密闭容器中发生可逆反应:A2(g)+B2(g)?2AB(g),达到平衡的标志是( )
| A. | 容器的总压强不随时间而变化 | |
| B. | 容器内气体的密度不再改变 | |
| C. | 单位时间内有nmolA2生成的同时有nmolB2消耗 | |
| D. | v正(A2)=2v逆(AB) |
3.能正确表示下列化学反应的离子方程式的是( )
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+=H2O | |
| B. | 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
13.下列不能用勒夏特列原理解释的是( )
| A. | 500℃时比室温更有利于合成氨的反应 | |
| B. | 红棕色的NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往加入过量的空气 | |
| D. | 实验室中常用排饱和食盐水的方法收集氯气 |
20.(1)25℃下,0.1mol/L醋酸pH为4,则此温下,该浓度醋酸的电离度为0.1%;电离平衡常数为10-7,水电离出的c(H+)=10-10mol/L,加少量水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值减小(填“增大”或“减小”)
(2)pH值相同的 HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100mL
①三种溶液中物质的量浓度最大的是CH3COOH;
②分别用0.1mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是V3>V1=V2.
③反应开始时,反应速率D.(填A、HCl最快;B、H2SO4最快;C、CH3COOH最快;D、一样快)
(3)下表是不同温度下水的离子积数据:
试回答下列问题:
①若25<t1<t2,则α>1×10-14(填“>”“<”或“=”)
②25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH-)=1000:1
③t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-)
(4)25℃时,若体积为Va,pH=a的某一元强酸与体积为Vb,pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,则a的取值范围是$\frac{7}{2}$<a<$\frac{14}{3}$.
(2)pH值相同的 HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100mL
①三种溶液中物质的量浓度最大的是CH3COOH;
②分别用0.1mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是V3>V1=V2.
③反应开始时,反应速率D.(填A、HCl最快;B、H2SO4最快;C、CH3COOH最快;D、一样快)
(3)下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
①若25<t1<t2,则α>1×10-14(填“>”“<”或“=”)
②25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH-)=1000:1
③t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-)
(4)25℃时,若体积为Va,pH=a的某一元强酸与体积为Vb,pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,则a的取值范围是$\frac{7}{2}$<a<$\frac{14}{3}$.
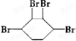
18.如图代表周期表中的几种短周期元素,下列说法中错误的是( )

| A. | ED4分子中各原子均达8电子结构 | |
| B. | AD3和ED4两分子的中心原子均为sp3杂化 | |
| C. | A、B、C第一电离能的大小顺序为C>B>A | |
| D. | C、D气态氢化物稳定性强弱和沸点高低均为C>D |
 .X与Y形成的离子化合物的电子式为
.X与Y形成的离子化合物的电子式为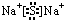 ,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.
,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.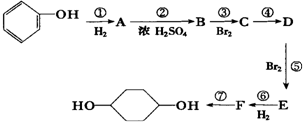 已知实验室由
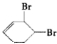
已知实验室由 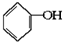 合成
合成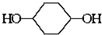 的反应流程如下 (部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基)
的反应流程如下 (部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基) 、D
、D
 、
、