题目内容
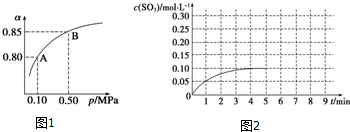
13.下列不能用勒夏特列原理解释的是( )| A. | 500℃时比室温更有利于合成氨的反应 | |
| B. | 红棕色的NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往加入过量的空气 | |
| D. | 实验室中常用排饱和食盐水的方法收集氯气 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,且存在平衡移动,否则勒夏特列原理不适用.
解答 解:A、合成氨反应为放热反应,升高温度不利用平衡向正方向移动,但主要考虑催化剂的活性和反应速率,与平衡移动无关,不能用勒夏特列原理解释,故A错误;
B、存在平衡2NO2?N2O4,加压条件减小,混合气体颜色变深,但压强增大平衡正向移动,颜色变浅,能用勒夏特利原理解释,故B正确;
C、存在平衡2SO2+O2(g)?2SO3(g),加入过量的空气,平衡向正反应方向移动,提高二氧化硫的转化率,能用勒夏特利原理解释,故C正确;
D、氯水中存在平衡Cl2+H2O?HCl+HClO,饱和氯化钠中氯离子浓度较大,可抑制水的溶解,可用勒夏特列原理解释,故D正确;
故选A.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆过程,且平衡发生移动.

练习册系列答案
相关题目
3.下列叙述正确的是( )
| A. | 非极性键不可能存在于离子化合物中 | |
| B. | 制催化剂的材料和制耐高温、耐腐蚀的合金材料可在过渡元素中寻找 | |
| C. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| D. | 单质分子中均不存在化学键 |
4.下列事实能说明氯元素原子得电子能力比硫元素强的是( )
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S强 ④HCl的还原性比H2S强
⑤HClO的酸性比H2SO4强 ⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑦Cl2能与H2S反应生成S
⑧还原性:Cl->S2-.
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S强 ④HCl的还原性比H2S强
⑤HClO的酸性比H2SO4强 ⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑦Cl2能与H2S反应生成S
⑧还原性:Cl->S2-.
| A. | ③④⑤⑦⑧ | B. | ③⑥⑦ | C. | ③⑥⑦⑧ | D. | ①②③④⑤⑥⑦⑧ |
2.分子式为C3H4Cl2的链状有机物的同分异构体共有(不包括立体异构)( )
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
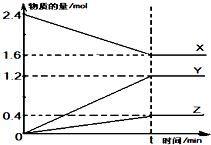 在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.
在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡. ;属于共价化合物(填“共价”或“离子”);
;属于共价化合物(填“共价”或“离子”);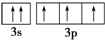 违背了泡利不相容原理;
违背了泡利不相容原理;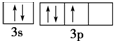 违背了洪特规则.
违背了洪特规则.