题目内容
17. (1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:
(1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)工业上CO 也用于合成甲醇:
CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ•mol-1.一定压强下,向容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示.
①p1小于p2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=$(\frac{V}{a})^{2}$(mol•L-1)-2;
③保持其它条件不变,下列措施中能够增大上述合成甲醇反应的反应速率、且能提高CO转化率的是cd.(填字母).
a.使用高效催化剂 b.降低反应温度 c.通入H2d.再增加a mol CO和2a molH2 e.不断将CH3OH从反应混合物中分离出来.
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、纯液体的浓度为常数,不需要写固体、纯液体;
(2)①分析图象依据定一议二的方法分析,反应是气体体积减小的反应,温度一定,压强增大平衡正向进行,一氧化碳转化率增大;
②100°C时一氧化碳的转化率为0.5,结合化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
③影响反应速率的因素有温度、浓度、压强和催化剂,影响平衡移动的因素有温度、浓度和压强,据此分析.
解答 解:(1)反应:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)的平衡常数k=$\frac{[C{O}_{2}]}{[CO]}$,
由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应,即△H<0,
故答案为:$\frac{[C{O}_{2}]}{[CO]}$;<;
(2)CO(g)+2H2(g)?CH3OH(g),△H=-90.1kJ•mol-1在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇;
①分析图象依据定一议二的方法分析,反应是气体体积减小的反应,温度一定,压强增大平衡正向进行,一氧化碳转化率增大,所以P1<P2;
故答案为:小于;
②100°C时一氧化碳的转化率为0.5,则
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) $\frac{a}{V}$ $\frac{2a}{V}$ 0
变化量(mol/L) $\frac{a}{2V}$ $\frac{a}{V}$ $\frac{a}{2V}$
平衡量(mol/L) $\frac{a}{2V}$ $\frac{a}{V}$ $\frac{a}{2V}$
结合平衡常数概念计算得到;平衡常数K=$\frac{\frac{a}{2V}}{\frac{a}{2V}×(\frac{a}{V})^{2}}$=$(\frac{V}{a})^{2}$(mol•L-1)-2;
故答案为:$(\frac{V}{a})^{2}$(mol•L-1)-2;
③a.使用高效催化剂,反应速率加快,但平衡不移动,故不选;
b.降低反应温度,反应速率减慢,故不选;
c.通入H2,反应速率加快,平衡正向移动,CO的转化率增大,故选;
d.在其它条件不变的情况下,再增加a mol CO和2a molH2,相当于增大压强,平衡正向进行,达到新平衡时一氧化碳转化率增大,故选;
e.不断将CH3OH从反应混合物中分离出来,反应速率减慢,故不选;
故答案为:cd.
点评 本题考查了化学平衡常数表达式书写以及计算、化学平衡影响因素分析判断、化学平衡状态的判断,掌握基础是关键,题目难度中等.

| A. | NA个氢氧化铁胶粒的质量为107g | |
| B. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| C. | 在50g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA | |
| D. | 在密闭容器中,0.5molH2和0.5molN2充分反应后得不到NA个NH3分子 |
| A. | CaCl2 K2S | B. | CO2 Na2O2 | C. | NaOH HCl | D. | NH4Cl CaH2 |
| A. | FeO+HNO3(溶液) | B. | 过量铁+稀硫酸 | ||
| C. | FeCl3(溶液)+过量铁 | D. | Fe+CuSO4(溶液) |
| A. | 室温时,在水电离出c(H+)=1.0×10-12mol•L-1的溶液中,K+、Na+、HCO3-、Cl-一定能大量共存 | |
| B. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 常温下,pH=2的醋酸溶液中所含有的H+数为0.01 NA | |
| D. | 将92 g N2O4晶体放入容器中,恢复到常温常压时,所含气体分子数大于NA |
| A. |  Cl2的收集 | B. |  HCl的收集 | C. |  NH3的收集 | D. |  NO的收集 |
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 反应产物的总焓大于反应物的总焓时,△H>0 | |
| C. | △H的大小与热化学方程式中的各物质的化学计量数无关 | |
| D. | 在化学反应中,发生物质变化的同时不一定发生能量变化 |
| A. | 3n-12 | B. | 3n-6 | C. | 3n-4 | D. | 2n-4 |
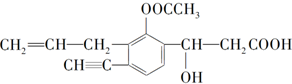 某有机化合物结构简式为
某有机化合物结构简式为