题目内容
9.下列一定能说明HNO2是弱电解质的是( )①相同条件下,同浓度的HNO2的导电性比盐酸弱 ②用HNO2作导电实验,灯泡很暗
③HNO2能使石蕊试液变红 ④0.1mol/L HNO2溶液的c(H+)=10-2mol/L.
| A. | ①②③ | B. | ②③④ | C. | ①④ | D. | ②④ |
分析 只有部分电离的电解质是弱电解质,只要证明亚硝酸部分电离就说明亚硝酸是弱电解质,据此分析解答.
解答 解:①相同条件下,同浓度的HNO2的导电性比盐酸弱,HCl是强电解质,则亚硝酸部分电离,为弱电解质,故正确;
②溶液导电能力与离子浓度成正比,用HNO2作导电实验,灯泡很暗,说明亚硝酸溶液中离子浓度较低,但不能说明亚硝酸部分电离,所以不能说明亚硝酸是弱电解质,故错误;
③HNO2能使石蕊试液变红,说明亚硝酸电离生成氢离子,但不能说明亚硝酸部分电离,所以不能说明亚硝酸是弱电解质,故错误;
④0.1mol/L HNO2溶液的c(H+)=10-2mol/L<0.1mol/L,说明亚硝酸部分电离,为弱电解质,故正确;
故选C.
点评 本题考查弱电解质的判断,侧重考查基本概念,强弱电解质的根本区别是电离程度,不能根据溶液酸碱性、溶液导电能力、溶质溶解度等判断强弱电解质,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.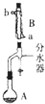 实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
物质的相关数据如下表:
(1)制备乙酸正丁酯
①在干燥的50ml圆底烧瓶中,加入3.7g的正丁醇和3.3g冰醋酸,再加入2~3滴浓硫酸,摇匀,投入1~2粒沸石 按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口.打开冷凝水,圆底烧瓶在石棉网上用小火加热.在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.反应达到终点后,停止加热,记录分出的水的体积.
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用适量的水洗涤.有机层继续用一定体积10%Na2CO3洗涤至中性,再用适量的水洗涤,最后将有机层转移至锥形瓶中,再加入少量无水硫酸镁固体.静置片刻,过滤除去硫酸镁固体.
③将②处理后的乙酸正丁酯滤入50 mL 烧瓶中,进行蒸馏纯化,收集126.1℃的馏分,得乙酸正丁酯3.5g.
回答有关问题:
(1)装置B的名称是球形冷凝管
(2)步骤①中判断反应终点的依据是分水器中的水层不再增加时,视为反应的终点
(3)产品的精制过程步骤②中,第一次水洗的目的是洗去大部分的硫酸和醋酸等用饱和Na2CO3溶液洗涤有机层,该操作的目的是除去产品中含有的残留酸等杂质第二次洗的目的是洗去乙酸正丁酯中的盐分实验中加入少量无水硫酸镁的目的是干燥
(4)下列关于蒸馏操作的说法,正确的是B
A、温度计的水银柱应插入到液面以下
B、蒸馏过程中,加入沸石(碎瓷片)的目的是防止暴沸
C、冷凝管进出水的方向是上进下出
D、为提高蒸馏的速度,可以不用石棉网而直接用酒精灯进行加热.
(5)步骤③的常压蒸馏,需收126.1℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂
(6)该实验过程中,列式计算生成乙酸正丁酯的产率(保留2位有效数字)60%.
 实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
物质的相关数据如下表:
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在干燥的50ml圆底烧瓶中,加入3.7g的正丁醇和3.3g冰醋酸,再加入2~3滴浓硫酸,摇匀,投入1~2粒沸石 按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口.打开冷凝水,圆底烧瓶在石棉网上用小火加热.在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.反应达到终点后,停止加热,记录分出的水的体积.
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用适量的水洗涤.有机层继续用一定体积10%Na2CO3洗涤至中性,再用适量的水洗涤,最后将有机层转移至锥形瓶中,再加入少量无水硫酸镁固体.静置片刻,过滤除去硫酸镁固体.
③将②处理后的乙酸正丁酯滤入50 mL 烧瓶中,进行蒸馏纯化,收集126.1℃的馏分,得乙酸正丁酯3.5g.
回答有关问题:
(1)装置B的名称是球形冷凝管
(2)步骤①中判断反应终点的依据是分水器中的水层不再增加时,视为反应的终点
(3)产品的精制过程步骤②中,第一次水洗的目的是洗去大部分的硫酸和醋酸等用饱和Na2CO3溶液洗涤有机层,该操作的目的是除去产品中含有的残留酸等杂质第二次洗的目的是洗去乙酸正丁酯中的盐分实验中加入少量无水硫酸镁的目的是干燥
(4)下列关于蒸馏操作的说法,正确的是B
A、温度计的水银柱应插入到液面以下
B、蒸馏过程中,加入沸石(碎瓷片)的目的是防止暴沸
C、冷凝管进出水的方向是上进下出
D、为提高蒸馏的速度,可以不用石棉网而直接用酒精灯进行加热.
(5)步骤③的常压蒸馏,需收126.1℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂
(6)该实验过程中,列式计算生成乙酸正丁酯的产率(保留2位有效数字)60%.
20.下列化合物中既有离子键又有共价键的是( )
| A. | KBr | B. | NaOH | C. | HBr | D. | MgCl2 |
17.欧洲航天局的惠更斯号探测器首次成功登陆土星的最大卫星--土卫六.科学家对探测器发回的数据进行了分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其它碳氢化合物.下列关于碳氢化合物的叙述正确的是( )
| A. | 碳氢化合物的通式为CnH2n+2 | B. | 芳香烃属于碳氢化合物 | ||
| C. | 乙炔是含碳量最高的碳氢化合物 | D. | 溴苯属于碳氢化合物 |
4.下列有关除杂的操作中不正确的是( )
| A. | FeSO4溶液中含少量CuSO4杂质:加入过量的Fe粉,过滤 | |
| B. | 碳酸钠粉末中含有少量碳酸氢钠粉末:加热 | |
| C. | 除去FeCl3溶液中的FeCl2:加入氯水 | |
| D. | CO2中混有HCl气体:通入饱和的碳酸钠溶液 |
14.下列图示与对应的叙述一定正确的是( )


| A. | 图1所示反应:X(g)+2Y(g)?3Z(g),b曲线表示的一定是增大压强 | |
| B. | 图2表示催化剂能改变化学反应的焓变 | |
| C. | 图3表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)═N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 图3表示向稀CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
1.在恒温下的密闭容器中,有可逆反应:2NO(g)+O2(g)?2NO2(g)(反应放热),能说明已达到平衡状态的是( )
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | N2O4和NO2的浓度相等 | |
| C. | 混合气体的颜色保持不变 | |
| D. | 单位时间内生成1mol O2的同时,生成1molNO |
18.下列实验中,不能观察到明显变化的是( )
| A. | 把Cl2通入FeCl2溶液中 | |
| B. | 把绿豆大的钾投入少量水中 | |
| C. | 把一段打磨过的镁带放入少量冷水中 | |
| D. | 把溴水滴加到淀粉KI溶液中 |
19.下列说法中错误的是( )
| A. | 原子间通过共用电子对所形成的化学键叫共价键 | |
| B. | 成键原子间原子轨道重叠越多,共价键越牢固 | |
| C. | 对双原子分子来讲,键能越大,含有该键的分子越稳定 | |
| D. | 键长越长,化学键越牢固 |