7.下列事实与氢键有关的是( )
| A. | 水结成冰体积膨胀 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
3.关于下列物质的结构或性质分析正确的是( )
| A. | CH2O和CO2分子中的中心原子均采用sp2杂化 | |
| B. | 甲胺(分子式CH3NH2)的沸点比三甲胺(分子式(CH3)3N)的沸点高 | |
| C. | C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子 | |
| D. | CH3SH 的相对分子质量比CH3OH大,因此前者的沸点高 |
2.下列关于硅原子的核外电子排布表示式(或排布图)中,错误的是( )
| A. | 1s22s22p63s23p2 | B. | [Ne]3s23p2 | ||
| C. | 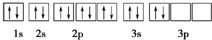 | D. |  |
18.C、N、O、Al、Fe、Cu是常见的六种元素.
(1)Fe位于元素周期表的第四周期第ⅤⅢ族,Cu的基态原子价电子排布式为3d104s1,
Al原子的基态原子核外有13种运动状态不同的电子.
(2)用“>”或“<”填空:
(3)10g铁放在40mL硝酸溶液中,微热,充分反应后收集到1.792L(标准状况)混合
气体(NO2、NO),溶液中残留4.4g固体.写出上述反应的总的化学方程式5Fe+14HNO3$\frac{\underline{\;\;△\;\;}}{\;}$5Fe(NO3)2+NO2↑+3NO↑+7H2O.
(4)Fe(s)+O2(g)=FeO(s)△H=-272.0kJ/mol
Al(s)+O2(g)=Al2O3(s)△H=-1675.7kJ/mol
Al的单质和FeO反应的热化学方程式是2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1.
0 167760 167768 167774 167778 167784 167786 167790 167796 167798 167804 167810 167814 167816 167820 167826 167828 167834 167838 167840 167844 167846 167850 167852 167854 167855 167856 167858 167859 167860 167862 167864 167868 167870 167874 167876 167880 167886 167888 167894 167898 167900 167904 167910 167916 167918 167924 167928 167930 167936 167940 167946 167954 203614
(1)Fe位于元素周期表的第四周期第ⅤⅢ族,Cu的基态原子价电子排布式为3d104s1,
Al原子的基态原子核外有13种运动状态不同的电子.
(2)用“>”或“<”填空:
| 电负性 离子半径 键的极性 | 熔点 |
| N<O O2->Al3+ C-H<H-O | Al<Al2O3 |
气体(NO2、NO),溶液中残留4.4g固体.写出上述反应的总的化学方程式5Fe+14HNO3$\frac{\underline{\;\;△\;\;}}{\;}$5Fe(NO3)2+NO2↑+3NO↑+7H2O.
(4)Fe(s)+O2(g)=FeO(s)△H=-272.0kJ/mol
Al(s)+O2(g)=Al2O3(s)△H=-1675.7kJ/mol
Al的单质和FeO反应的热化学方程式是2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1.
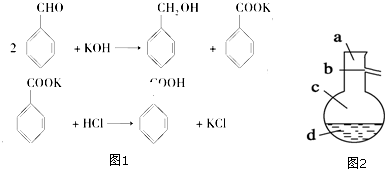
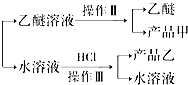
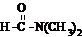 溶于水
溶于水