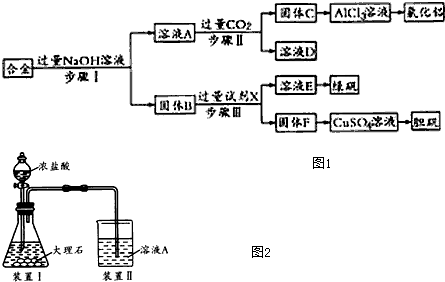
题目内容
6.实验室制备苯甲醇和苯甲酸的化学原理是(如图1):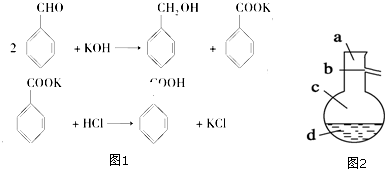
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃;苯甲酸的熔点为 121.7℃,沸点为 249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如下所示:
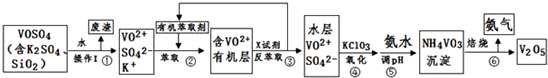
苯甲醛$→_{放置24h}^{KOH、H_{2}O}$白色糊状物$→_{操作Ⅰ}^{水、乙醚}$
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是萃取、分液.
(2)操作Ⅱ的名称是蒸馏,产品甲是苯甲醇.
(3)操作Ⅲ的名称是过滤,产品乙是苯甲酸.
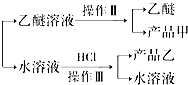
(4)如图2所示,操作Ⅱ中温度计水银球放置的位置应是b(填“a”、“b”、“c”或“d”).
该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是冷凝管、牛角管(尾接管)、酒精灯、锥形瓶.
(5)工业产品乙中含少量不溶性的杂质和少量氯化钠,实验室提纯乙的主要操作步骤为加热浓缩,趁热过滤,冷却结晶,过滤洗涤.
分析 由流程可知,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,则乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸,以此来解答.
解答 解:由流程可知,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,则乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸,
(1)据上述分析,操作Ⅰ为萃取、分液,故答案为:萃取、分液;
(2)乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇,故答案为:蒸馏;苯甲醇;
(3)水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸,故答案为:过滤;苯甲酸;
(4)蒸馏时,温度计的水银球应在支管口,蒸馏实验中需要的玻璃仪器有:蒸馏烧瓶、温度计、冷凝管、牛角管(尾接管)、酒精灯、锥形瓶,
故答案为:b;冷凝管、牛角管(尾接管)、酒精灯、锥形瓶;
(5)苯甲酸的溶解度随温度的升高而增大,升温使苯甲酸溶于水,并加热浓缩,过滤除掉不溶性杂质,将滤液降温,苯甲酸溶解度减小,就会结晶析出,然后过滤可得苯甲酸,故答案为:加热浓缩,趁热过滤,冷却结晶,过滤洗涤.
点评 本题考查有机物的分离提纯,为高频考点,把握有机物的性质及分离流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.工业上设计将VOSO4、SO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是SiO2(写化学式),操作Ⅰ的名称过滤.
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率.
③中X试剂为H2SO4.
(3)④的离子方程式为ClO3-+6VO2++9H2O=Cl-+6VO3-+18H+.
(4)25℃时,取样进行试验分 析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为1.7-1.8.
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3mol•L-1.(已知:25℃时,K电[Fe(OH)3]=2.6×10-33)
(5)该工艺流程中,可以循环利用的物质有有机萃取剂和氨气.

请回答下列问题:
(1)步骤①所得废渣的成分是SiO2(写化学式),操作Ⅰ的名称过滤.
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率.
③中X试剂为H2SO4.
(3)④的离子方程式为ClO3-+6VO2++9H2O=Cl-+6VO3-+18H+.
(4)25℃时,取样进行试验分 析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3mol•L-1.(已知:25℃时,K电[Fe(OH)3]=2.6×10-33)
(5)该工艺流程中,可以循环利用的物质有有机萃取剂和氨气.
14.常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| X Y | Z |
| ①NaOH溶液 Al(OH)3 | 稀硫酸 |
| ②KOH溶液 SiO2 | 氢氟酸 |
| ③O2 N2 | H2 |
| ④FeCl3溶液 Cu | 浓硝酸 |
| A. | ①③ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
11.如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )

| A. | 常压下Z的单质沸点最高 | B. | 电负性W小于Y | ||
| C. | W的氢化物比X的氢化物稳定 | D. | R的单质在固态时属于原子晶体 |
18.反应4A(g)+5B(g)=4C(g)+6D(g)在0.5L密闭容器中进行,30s内A减少了0.90mol,则此反应的速率可表示为( )
| A. | v(B)=0.075mol/(L•s) | B. | v(A)=0.030mol/(L•s) | C. | v(C)=0.040mol/(L•s) | D. | v(D)=0.060mol/(L•s) |