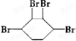
题目内容
7.下列事实与氢键有关的是( )| A. | 水结成冰体积膨胀 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
分析 氢键存在于N、O、F等电负性较强的非金属性形成的氢化物中,氢键是一种特殊的分子间作用力,作用力较范德华力强,非化学键,只影响物质的物理性质,不影响化学性质,以此解答该题.
解答 解:A.氢键具有方向性,氢键的存在迫使四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙,所以水结成冰时,体积增大,故A正确;
B.水的分解破坏的是化学键,不是氢键,故B错误;
C.CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高是与分子间作用力有关,分子间不存在氢键,与氢键无关,故C错误;
D.HF、HCl、HBr、HI的热稳定性与F、Cl、Br、I的非金属性有关,非金属性越强,其氢化物越稳定,同一主族的元素,非金属性随着原子序数的增加而减小,所以其氢化物的热稳定性逐渐减弱,与氢键无关,故D错误.
故选A.
点评 本题考查了氢键存在对物质性质的影响,题目难度不大,注意①氢键是一种分子间的相互作用,不属于化学键②能形成氢键的物质主要有NH3、H2O、HF③特征:比化学键弱,比分子间作用力强.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
15.工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示.下列有关说法正确的是 ( )


| A. | 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH | |
| B. | 饱和食盐水中先通入的气体为CO2 | |
| C. | 流程图中的系列操作中一定需要玻璃棒 | |
| D. |  如图所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性 |
2.下列关于硅原子的核外电子排布表示式(或排布图)中,错误的是( )
| A. | 1s22s22p63s23p2 | B. | [Ne]3s23p2 | ||
| C. | 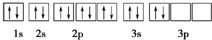 | D. |  |
12.有A、B、C、D、E五种短周期元素,A原子核外电子占据5条轨道,有两个未成对电子,B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍,C原子核外有9种不同运动状态的电子,D和C可以形成DC型离子化合物,且离子的电子层结构相同,E元素原子的最外层电子数比内层电子总数少6个.下列说法正确的是( )
| A. | 离子半径:D+>C- | |
| B. | EA2是原子晶体 | |
| C. | A和B形成的原子个数比为1:1的化合物分子是非极性分子 | |
| D. | 以上元素中形成的最高价氧化物对应的水化物酸性最强的是C |
19.在一个体积不变的密闭容器中发生可逆反应:A2(g)+B2(g)?2AB(g),达到平衡的标志是( )
| A. | 容器的总压强不随时间而变化 | |
| B. | 容器内气体的密度不再改变 | |
| C. | 单位时间内有nmolA2生成的同时有nmolB2消耗 | |
| D. | v正(A2)=2v逆(AB) |
 .X与Y形成的离子化合物的电子式为
.X与Y形成的离子化合物的电子式为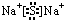 ,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.
,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.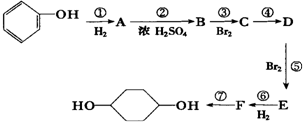 已知实验室由
已知实验室由 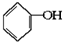 合成
合成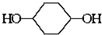 的反应流程如下 (部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基)
的反应流程如下 (部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基) 、D
、D
 、
、