8.下列说法中正确的是( )
| A. | 因为3O2═2O3是吸热反应,所以臭氧比氧气的化学性质更活泼 | |
| B. | H2O(g)→H2O(l)的过程放出大量的热,所以该过程是化学变化 | |
| C. | 需要加热才能发生的反应都是吸热反应 | |
| D. | 1 mol/L的稀H2SO4溶液与1 mol/L的稀Ba(OH)2溶液完全反应所放出的热量就是该反应的中和热 |
7.2011年3月,日本因发生9.0级特大地震而导致核电站的放射性物质严重泄漏.放射性物质主要包括${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs,${\;}_{53}^{131}$I可能会引发甲状腺疾病,${\;}_{55}^{137}$Cs则会造成人体造血系统和神经系统损伤.下列关于${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs的说法错误的是( )
| A. | ${\;}_{53}^{127}$I、${\;}_{53}^{131}$I、${\;}_{55}^{134}$Cs、${\;}_{55}^{137}$Cs是四种核素,两组同位素 | |
| B. | ${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs的中子数分别是78、82 | |
| C. | 在周期表中Cs与I位于同一周期 | |
| D. | 铯与碘能化合生成CsI |
6.下列叙述不正确的是( )
| A. | 根据一次能源与二次能源的划分,氢气为二次能源 | |
| B. | 空气、水、煤、天然气均为可再生资源 | |
| C. | 镁条燃烧时将部分化学能转化为光能 | |
| D. | 在火力发电时,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化 |
4.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 | |
| B. | 已知2 H2(g)+O2(g)=2 H2O(g)△H=-483.6 kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| C. | 已知2 C(s)+2 O2(g)=2 CO2(g)△H=a 2 C(s)+O2(g)=2 CO(g)△H=b,则a>b | |
| D. | 已知P(白磷,s)=P(红磷,s)△H<0,则白磷比红磷稳定 |
3.李克强总理在全国人大会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不相符的是( )
| A. | 用“绿色化学”工艺,使原料完全转化为目标产物 | |
| B. | 开发新能源,减少化石能源的使用,减少污染 | |
| C. | 开发新型电池,推广废旧电池的回收、处理经验 | |
| D. | 大量使用农药化肥,减少病虫害,提高粮食产量 |
2.恒温条件下用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
| A. | $\frac{{c(O{H^-})}}{{c(N{H_3}•{H_2}O)}}$ | B. | $\frac{{c(N{H_3}•{H_2}O)}}{{c(O{H^-})}}$ | ||
| C. | c(H+)和c(OH--)的乘积 | D. | OH-的物质的量 |
1.以钴酸锂(LiCoO2)为正极材料的锂离子电池已被广泛用作便携式电源,工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂,其中一种工艺流程如下:

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②LiCO3在不同温度下的溶解度如下表:回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:Li2O•Al2O3•4SiO2;
(2)反应Ⅱ中加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4,控制pH使Fe3+、Al3+完全沉淀;
(3)写出反应Ⅲ中生成沉淀A的离子方程式:Mg2++2OH-═Mg(OH)2↓、Ca2++CO32-═CaCO3↓;
(4)洗涤所得Li2O3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗;
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(2)反应Ⅱ中加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4,控制pH使Fe3+、Al3+完全沉淀;
(3)写出反应Ⅲ中生成沉淀A的离子方程式:Mg2++2OH-═Mg(OH)2↓、Ca2++CO32-═CaCO3↓;
(4)洗涤所得Li2O3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗;
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.
20.下列气体最易溶于水的是( )
| A. | 氨气 | B. | 氯气 | C. | 二氧化硫 | D. | 氯化氢 |
19.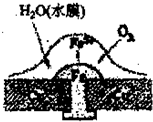 铜板上鉄柳钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀远离如图所示,下列有关此过程的说法不正确的是( )
铜板上鉄柳钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀远离如图所示,下列有关此过程的说法不正确的是( )
0 167733 167741 167747 167751 167757 167759 167763 167769 167771 167777 167783 167787 167789 167793 167799 167801 167807 167811 167813 167817 167819 167823 167825 167827 167828 167829 167831 167832 167833 167835 167837 167841 167843 167847 167849 167853 167859 167861 167867 167871 167873 167877 167883 167889 167891 167897 167901 167903 167909 167913 167919 167927 203614
 铜板上鉄柳钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀远离如图所示,下列有关此过程的说法不正确的是( )
铜板上鉄柳钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀远离如图所示,下列有关此过程的说法不正确的是( )| A. | 正极上的主要电极反应式:2H2O+O2+4e-→4OH- | |
| B. | 此过程中铜并未被腐蚀 | |
| C. | 电子从Cu流向Fe | |
| D. | 此过程中还可能涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
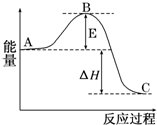 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ/mol.