题目内容
4.下列依据热化学方程式得出的结论正确的是( )| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 | |
| B. | 已知2 H2(g)+O2(g)=2 H2O(g)△H=-483.6 kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| C. | 已知2 C(s)+2 O2(g)=2 CO2(g)△H=a 2 C(s)+O2(g)=2 CO(g)△H=b,则a>b | |
| D. | 已知P(白磷,s)=P(红磷,s)△H<0,则白磷比红磷稳定 |
分析 A、醋酸是弱酸,其电离过程是吸热过程;
B、燃烧热是指完全燃烧1mol物质生成最稳定的化合物所放出的热量;
C、焦炭完全燃烧放出的热量高于不完全燃烧放出的热量;
D、物质具有的能量越低越稳定.
解答 解:A、中和热是指稀的强酸和强碱溶液发生中和反应生成1mol水时所放出的热量,醋酸是弱酸,其电离过程是吸热过,40.0g即1molNaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量,故A正确;
B、氢气的燃烧热必须是生成液态水的过程所放出的热量,液态水变为气态水是吸热的,氢气的燃烧热小于241.8kJ•mol-1,故B错误;
C、焦炭完全燃烧放出的热量高于不完全燃烧放出的热量,焓变是负值,即a<b,故C错误;
D、P (白磷,s)=P (红磷,s)△H<0,所以红磷的能量低于白磷的能量,所以白磷不如红磷稳定,故D错误.
故选A.
点评 本题考查学生燃烧热、中和热的概念以及热化学方程式的含义知识,注意教材知识的掌握是解答的关键,难度不大.

练习册系列答案
相关题目
14. “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )| A. | 分子中所有的原子共面 | |
| B. | 1molEGC与4molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 一定条件下的氧化产物能发生银镜反应 |
15.按元素原子的外围电子排布可将元素周期表分为s区、p区、d区、f区、ds区.其中非金属元素分布区域为( )
| A. | ds区 | B. | d区 | C. | f区 | D. | s区和p区 |
12.下列图示与对应的叙述相符的是( )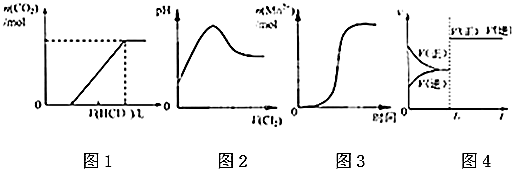

| A. | 图①表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图②表示0.1000 mol•L-1NaOH溶液滴定20.00mL 0.1000 mol•L-1HCl溶液所得到的滴定曲线 | |
| C. | 图③表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 | |
| D. | 图④表示某可逆反应生成物的量随反应时间变化的曲线,由图t时反应物转化率最大 |
19.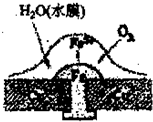 铜板上鉄柳钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀远离如图所示,下列有关此过程的说法不正确的是( )
铜板上鉄柳钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀远离如图所示,下列有关此过程的说法不正确的是( )
 铜板上鉄柳钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀远离如图所示,下列有关此过程的说法不正确的是( )
铜板上鉄柳钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀远离如图所示,下列有关此过程的说法不正确的是( )| A. | 正极上的主要电极反应式:2H2O+O2+4e-→4OH- | |
| B. | 此过程中铜并未被腐蚀 | |
| C. | 电子从Cu流向Fe | |
| D. | 此过程中还可能涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
9.化学用语是化学学科中最美的语言,下列有关化学用语使用不正确的是( )
| A. | 钙的元素符号:Ca | B. | NaCl的形成: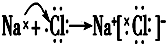 | ||
| C. | 二氧化碳的结构式:O=C=O | D. | S2-的结构示意图: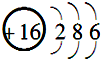 |
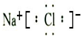 HCl
HCl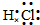
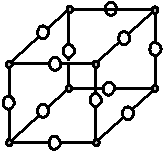 现有X、Y、Z、W原子序数依次增大的四种元素,常温下X元素单质的密度在自然界中最小,Y是短周期元素中未成对电子数与原子序数之比最大的原子,Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等,且Y与Z可形成多种气态化合物,W是常见的有色可变价金属单质,常温下可溶于Y的最高价氧化物水化物中,其基态原子的内层轨道全部排满电子,且最外层电子数为1.
现有X、Y、Z、W原子序数依次增大的四种元素,常温下X元素单质的密度在自然界中最小,Y是短周期元素中未成对电子数与原子序数之比最大的原子,Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等,且Y与Z可形成多种气态化合物,W是常见的有色可变价金属单质,常温下可溶于Y的最高价氧化物水化物中,其基态原子的内层轨道全部排满电子,且最外层电子数为1.