题目内容
19.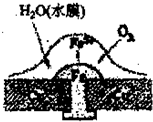 铜板上鉄柳钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀远离如图所示,下列有关此过程的说法不正确的是( )
铜板上鉄柳钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀远离如图所示,下列有关此过程的说法不正确的是( )| A. | 正极上的主要电极反应式:2H2O+O2+4e-→4OH- | |
| B. | 此过程中铜并未被腐蚀 | |
| C. | 电子从Cu流向Fe | |
| D. | 此过程中还可能涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
分析 根据图片知,水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,原电池放电时,电子从负极流向正极.
解答 解:根据图片知,水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀.
A、正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故A正确;
B、该原电池中铜作正极,原电池放电时,负极失电子容易被腐蚀,正极被保护,所以铜不被腐蚀,故B正确;
C、该原电池放电时,外电路上电子从负极铁流向正极铜,故C错误;
D、负极上发生的电极反应式为:Fe-2e-=Fe2+,正极上的电极反应式为:O2+2H2O+4e-=4OH-,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,容易被空气中的氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,故D正确;
故选C.
点评 本题以原电池原理为载体考查了金属的腐蚀,难度不大,明确钢铁发生析氢腐蚀和吸氧腐蚀的条件是解本题的关键,注意钢铁的吸氧腐蚀中还含有氢氧化亚铁生成氢氧化铁的反应.

练习册系列答案
相关题目
9.现有部分短周期元素的性质或原子结构如下表:
(1)A的气态氢化物的化学式是H2S,元素B(含8个中子)的一种同位素可测定文物年代,这种同位素的符号是146C.
(2)写出元素F的离子结构示意图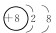 .
.
(3)写出G元素最高价氧化物对应的水化物的化学式是Al(OH)3.
(4)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与氢氧化钠溶液反应
(5)A、B、C、D四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种酸的是H2CO3,理由是碳酸属于弱酸,其它三种酸均为强酸.
(6)C、E、F、G四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由Al具有金属性或是金属.
(7)F的阴离子和G的阳离子的半径大小比较:F->Al3+(用离子符号表示)
(8)A、D的简单离子的还原性强弱:S2->Cl-(用离子符号表示)
| 元素编号 | 元素性质或原子结构 |
| A | 室温下其单质呈粉末状黄色固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最外层电子数比次外层电子数多3个 |
| D | 元素最高正价是+7价 |
| E | 主族元素中得电子能力最强 |
| F | 空气的主要成分之一,其某种同素异形体是保护地球地表环境的重要屏障 |
| G | 第3周期元素的简单离子中半径最小 |
(2)写出元素F的离子结构示意图
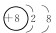 .
.(3)写出G元素最高价氧化物对应的水化物的化学式是Al(OH)3.
(4)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与氢氧化钠溶液反应
(5)A、B、C、D四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种酸的是H2CO3,理由是碳酸属于弱酸,其它三种酸均为强酸.
(6)C、E、F、G四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由Al具有金属性或是金属.
(7)F的阴离子和G的阳离子的半径大小比较:F->Al3+(用离子符号表示)
(8)A、D的简单离子的还原性强弱:S2->Cl-(用离子符号表示)
10.常温下,若将pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
| A. | 生成了一种强酸弱碱盐 | B. | 弱酸溶液和强碱溶液反应 | ||
| C. | 强酸溶液和弱碱溶液反应 | D. | 一元强酸溶液和一元强碱溶液 |
14.如表是不同温度下水的离子积数据:
若25<t1<t2,则α>(填“<”“>”或“=”)1×10-14.
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
4.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 | |
| B. | 已知2 H2(g)+O2(g)=2 H2O(g)△H=-483.6 kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| C. | 已知2 C(s)+2 O2(g)=2 CO2(g)△H=a 2 C(s)+O2(g)=2 CO(g)△H=b,则a>b | |
| D. | 已知P(白磷,s)=P(红磷,s)△H<0,则白磷比红磷稳定 |
11.X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构.下列说法正确的是( )
| A. | 非金属性:Y>Z | |
| B. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
8.下列描述中正确的是( )
| A. | CS2为直线形的极性分子 | |
| B. | CH4中键能、键长和键角均相同 | |
| C. | AB2为V形,则A一定为sp2杂化 | |
| D. | SiF4和SO32-的中心原子均为sp2杂化 |
 ⑧
⑧
 -CH3
-CH3