20. Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:
(1)Mn元素的原子结构示意图为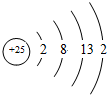 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子都具备的结构特点是有孤对电子;
②六氰合亚铁离子[Fe(CN)6]4-中的配体CN-中C原子的杂化轨道类型是sp,写出一种与CN-互为等电子体的单质分子的结构式N≡N;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚.丙酮等有机溶剂.据此判断三氯化铁晶体为分子晶体;
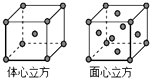
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2.
(5)假设体心立方晶胞的铁原子半径为r,晶胞的边长为a,则该晶胞的空间利用率是68%.
 Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元素 | Mn | Fe | |
| 电离能 KJ/mol | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(1)Mn元素的原子结构示意图为
 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子都具备的结构特点是有孤对电子;
②六氰合亚铁离子[Fe(CN)6]4-中的配体CN-中C原子的杂化轨道类型是sp,写出一种与CN-互为等电子体的单质分子的结构式N≡N;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚.丙酮等有机溶剂.据此判断三氯化铁晶体为分子晶体;
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2.
(5)假设体心立方晶胞的铁原子半径为r,晶胞的边长为a,则该晶胞的空间利用率是68%.
19.有下列离子晶体立体结构示意图:
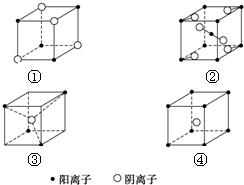
若以M代表阳离子,以N代表阴离子,则各离子晶体的组成表达式完全正确的组合是( )

若以M代表阳离子,以N代表阴离子,则各离子晶体的组成表达式完全正确的组合是( )
| A. | ①MN ②MN2 ③MN2 ④MN | B. | ①MN ②MN2 ③MN3 ④MN4 | ||
| C. | ①MN2 ②MN2 ③MN2 ④MN | D. | ①MN ②MN ③MN2 ④MN2 |
16.某化学式为C3H6O2的有机物的PMR谱有三个信号蜂,其强度比为3:2:1,则该有机物的结构简式不可能是( )
| A. | CH3CH2COOH | B. | CH3COOCH3 | C. | HCOOCH2CH3 | D. | CH3COCH2OH |
15.常见元素A、B、C、D、E的原子序数依次增大,其相关信息如表:
(1)E位于元素周期表的位置是,其基态原子未成对电子有4个.
(2)B、C、D的电负性由大到小的顺序是Cl>N>C(用元素符号表示).
(3)C单质分子中δ键和π键的个数比是,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
(4)D的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O.
(5)由A、B两种元素组成的非极性分子有多种,其中乙是一个分子含4个原子的分子,乙的电子式是.已知乙的燃烧热为1200kJ∕mol,乙燃烧热的热化学反应方程式是C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-1200kJ/mol.
(6)在一定温度下,向一个容积不变的密闭容器中充入1molC2和3molA2,发生反应:Y2(g)+3A2(g)?2YA3(g)△H=-akJ/mol.在该条件下达到平衡时放出的热量为bkJ,其平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$(用化学式表示).若起始向此容器中充入2molAH3,在相同温度下达到平衡时,反应过程中吸收的热量为ckJ,则a、b、c三者之间的关系为a=b+c(用一个式子表示).
| 元素 | 相关信息 |
| A | 该元素的一种核素无中子 |
| B | 基态原子核外只有三个能级,且各能级电子数相等 |
| C | 基态原子最外层电子数是其内层电子总数的2.5倍 |
| D | 一个D-离子含18个电子 |
| E | +3价离子3d能级为半充满 |
(2)B、C、D的电负性由大到小的顺序是Cl>N>C(用元素符号表示).
(3)C单质分子中δ键和π键的个数比是,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
(4)D的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O.
(5)由A、B两种元素组成的非极性分子有多种,其中乙是一个分子含4个原子的分子,乙的电子式是.已知乙的燃烧热为1200kJ∕mol,乙燃烧热的热化学反应方程式是C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-1200kJ/mol.
(6)在一定温度下,向一个容积不变的密闭容器中充入1molC2和3molA2,发生反应:Y2(g)+3A2(g)?2YA3(g)△H=-akJ/mol.在该条件下达到平衡时放出的热量为bkJ,其平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$(用化学式表示).若起始向此容器中充入2molAH3,在相同温度下达到平衡时,反应过程中吸收的热量为ckJ,则a、b、c三者之间的关系为a=b+c(用一个式子表示).
14. 体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )
体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )
 体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )
体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )| A. | 曲线a是500℃时的图象 | |
| B. | 从0到t1时刻,反应物X(g)的$\frac{v(300℃)}{v(500℃)}$>1 | |
| C. | t2时刻生成物Z的量$\frac{{△v}_{1}(300℃)}{{△v}_{1}(500℃)}$ | |
| D. | t3时刻改变的条件可能是降温 |
13.正丁醛经催化加氢可制备1-丁醇.为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:
粗品$→_{操作1}^{饱和NaHSO3溶液}$滤液$→_{萃取}^{乙醛}$操作2有机层$→_{操作3}^{固体干燥剂}$1-丁醇乙醚(操作4)纯品
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃.则操作1~4分别是( )
粗品$→_{操作1}^{饱和NaHSO3溶液}$滤液$→_{萃取}^{乙醛}$操作2有机层$→_{操作3}^{固体干燥剂}$1-丁醇乙醚(操作4)纯品
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃.则操作1~4分别是( )
| A. | 萃取、过滤、蒸馏、蒸馏 | B. | 过滤、分液、蒸馏、萃取 | ||
| C. | 过滤、蒸馏、过滤、蒸馏 | D. | 过滤、分液、过滤、蒸馏 |
12.下列说法正确的是( )
| A. | 钠久置于空气中,可以和空气中的有关物质反应,最终生成NaHCO3 | |
| B. | 氮气的化学性质通常非常稳定,但在放电条件下可以与O2反应生成NO2 | |
| C. | 海水制食盐、石油分馏、焰色反应都属于物理变化 | |
| D. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 |
11.设NA代表阿伏加德罗常数的数值,下列说法中正确的是;( )
0 167681 167689 167695 167699 167705 167707 167711 167717 167719 167725 167731 167735 167737 167741 167747 167749 167755 167759 167761 167765 167767 167771 167773 167775 167776 167777 167779 167780 167781 167783 167785 167789 167791 167795 167797 167801 167807 167809 167815 167819 167821 167825 167831 167837 167839 167845 167849 167851 167857 167861 167867 167875 203614
| A. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| B. | 常温下,16gO2和O3的混合气体中含有的氧原子数为NA | |
| C. | 标准状况下,22.4L NO和22.4LO2 混合后所得气体中分子总数为1.5NA | |
| D. | 将11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
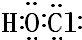 .
.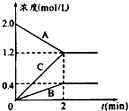 表示800℃时含有A、B、C三种气体的体系中各物质浓度(mol/L)随时间变化的情况如图所示
表示800℃时含有A、B、C三种气体的体系中各物质浓度(mol/L)随时间变化的情况如图所示