题目内容
11.设NA代表阿伏加德罗常数的数值,下列说法中正确的是;( )| A. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| B. | 常温下,16gO2和O3的混合气体中含有的氧原子数为NA | |
| C. | 标准状况下,22.4L NO和22.4LO2 混合后所得气体中分子总数为1.5NA | |
| D. | 将11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
分析 A、重水的摩尔质量为20g/mol;
B、氧气和臭氧均由氧原子构成;
C、一氧化氮与氧气反应生成二氧化氮,二氧化氮与四氧化二氮之间存在转化平衡,所以反应后的物质中含有的分子数减小;
D、氯气所处的状态不明确.
解答 解:A、重水(D2O)的相对分子质量为20,1.8 g重水(D2O)的物质的量为0.09mol,含有的质子数和电子数均为0.9NA,故A错误;
B、氧气和臭氧均由氧原子构成,16gO2和O3的混合气体中氧原子的物质的量为1 mol,氧原子数为NA,故B正确;
C、根据2NO+O2═2NO2可知:标准状况下,22.4 L NO即1molNO 和22.4 L O2 即1mol氧气混合后所得气体的物质的量为1.5mol,但由于NO2气体中存在平衡:2NO2?N2O4,导致分子总数小于1.5 NA,故C错误;
D、缺少温度和压强,无法确定11.2 L Cl2的物质的量,无法确定转移的电子数,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,难度不大.

练习册系列答案
相关题目
1.如图是达到平衡后,外界条件变化时,2SO2(g)+O2(g)?2SO3(g);△H<0反应速率的变化情况(v′表示正反应速率,v″表示逆反应速率).下列说法中正确的是( )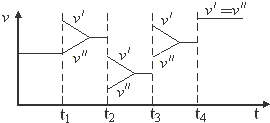

| A. | t1时改变的条件是增大体系的压强 | B. | t2时改变的条件是减小压强 | ||
| C. | t3时改变的条件是升高温度 | D. | t4时改变的条件是使用了催化剂 |
2.黄铜矿(CuFeS2)是提取铜的主要原料,其煅烧产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2→2Cu2O+2SO2…①2Cu2O+Cu2S→6Cu+SO2…②.则( )
| A. | 反应①中还原产物只有SO2 | |
| B. | 反应②中Cu2S只发生了氧化反应 | |
| C. | 将1 molCu2S冶炼成 2mol Cu,需要O21mol | |
| D. | 若1molCu2S完全转化为2molCu,则转移电子数为2NA |
19.如图表示M的结构简式,下列有关M的说法正确的是( )
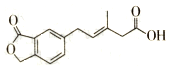

| A. | M可以发生加成、加聚、水解、酯化等反应 | |
| B. | l mol M最多可以与3 mol NaOH反应 | |
| C. | M苯环上的一氯取代物有两种不同结构 | |
| D. | l molM最多可以与5 mol H2发生加成反应 |
6. 酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )
酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )
 酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )
酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )| A. | 由图中信息可知 HA为强酸,N点为恰好中和 | |
| B. | 常温下一定浓度的 MA稀溶液的pH<7 | |
| C. | K点所对应的溶液中离子浓度的大小关系:c(M+)>c(OH-)>c(A-)>c(H+) | |
| D. | K点对应的溶液中,溶液的pH>13,c(HA)+c(A-)=0.25mol•L-1 |
16.某化学式为C3H6O2的有机物的PMR谱有三个信号蜂,其强度比为3:2:1,则该有机物的结构简式不可能是( )
| A. | CH3CH2COOH | B. | CH3COOCH3 | C. | HCOOCH2CH3 | D. | CH3COCH2OH |
3.下表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题;
(1)由实验可推知,反应物的总能量>产物的总能量(填“<““>““一“).
(2)实验4和5表明,固体反应物的表面积 对反应速率有影响,能表明同一规律的实验还有 (填实验序号);
(3)仅表明反应物浓度对反应速率产生影响的实验有l、3、4、6、8及2、5(填实验序号);
(4)本实验中影响反应速率的其他因素还有反应温度,其实验序号是6和7或8和9.
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
(1)由实验可推知,反应物的总能量>产物的总能量(填“<““>““一“).
(2)实验4和5表明,固体反应物的表面积 对反应速率有影响,能表明同一规律的实验还有 (填实验序号);
(3)仅表明反应物浓度对反应速率产生影响的实验有l、3、4、6、8及2、5(填实验序号);
(4)本实验中影响反应速率的其他因素还有反应温度,其实验序号是6和7或8和9.
20.为高空或海底作业提供氧气的物质是( )
| A. | KClO3 | B. | KMnO4 | C. | Na2O2 | D. | H2O |
1.能证明SO2中混有CO2的方法是( )
| A. | 通过品红溶液 | |
| B. | 通过澄清石灰水 | |
| C. | 先通过高锰酸钾溶液,再通过澄清石灰水 | |
| D. | 先通过澄清石灰水,再通过高锰酸钾溶液 |