题目内容
17.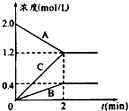 表示800℃时含有A、B、C三种气体的体系中各物质浓度(mol/L)随时间变化的情况如图所示
表示800℃时含有A、B、C三种气体的体系中各物质浓度(mol/L)随时间变化的情况如图所示(1)该反应的反应物是A.
(2)该反应的化学反应方程式为2A?B+3C.
(3)若达到平衡状态的时间是2min,A物质的平均反应速率为0.4mol/(L•min).
分析 (1)随反应进行,反应物的浓度降低,生成物的浓度增大,据此结合图象判断;
(2)根据浓度变化量之比等于化学计量数之比确定化学计量数,t是达到平衡状态,为可逆反应,据此书写方程式;
(4)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,根据v=$\frac{△c}{△t}$计算A物质的平均反应速率.
解答 解:(1)由图可知,随反应进行A的浓度降低,A为反应物,B、C的浓度增大,故B、C为生成物,故答案为:A;
(2)由图可知,△c(A)=)=2.0mol/L-1.2mol/L=0.8mol/L,△c(B)=0.4mol/L,△c(C)=1.2mol/L,A、B、C化学计量数之比等于浓度变化量之比为0.8mol/L:0.4mol/L:1.2mol/L=2:1:3,反应为可逆反应,故反应方程式为2A?B+3C,故答案为:2A?B+3C;
(3)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,所v(A)=$\frac{0.8mol/L}{2min}$=0.4mol/(L•min),故答案为:0.4mol/(L•min).
点评 本题考查化学反应速率、浓度-时间图象等,注重基础,旨在考查学生对基础知识的掌握,主要是平反应速率概念的计算分析,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.在含有0.6molCl-、0.8molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响).若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x.则( )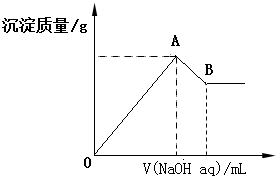

| A. | x=$\frac{2a}{5-a}$ | |
| B. | x的取值范围是0<x<$\frac{11}{32}$ | |
| C. | A点横坐标的值随x发生变化 | |
| D. | 若B点横坐标为200mL时,c(NaOH)=7.0mol/L |
5.下列说法正确的是( )
| A. | 按系统命名法,有机物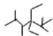 的名称是 2,2,4,5-四甲基-3,3-二乙基己烷 的名称是 2,2,4,5-四甲基-3,3-二乙基己烷 | |
| B. | 苯、甲苯、二甲苯互为同系物,均能使酸性高锰酸钾溶液褪色 | |
| C. | 等质量的苯、乙炔(CH≡CH)、乙烯和甲烷分别在氧气中充分燃烧,所消耗的氧气的量依次增加 | |
| D. | 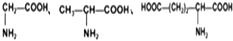 三种氨基酸之间脱水,最多可生成6种二肽 三种氨基酸之间脱水,最多可生成6种二肽 |
12.下列说法正确的是( )
| A. | 钠久置于空气中,可以和空气中的有关物质反应,最终生成NaHCO3 | |
| B. | 氮气的化学性质通常非常稳定,但在放电条件下可以与O2反应生成NO2 | |
| C. | 海水制食盐、石油分馏、焰色反应都属于物理变化 | |
| D. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 |
9.在下列实验中,应将温度计插入水浴中的是( )
| A. | 在实验室中蒸馏石油 | B. | 由苯制硝基苯 | ||
| C. | 由酒精制乙烯 | D. | 由乙酸与乙醇反应制乙酸乙酯 |
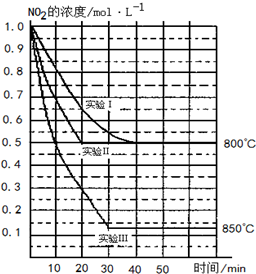 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题: 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示: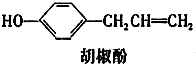 胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法,其中正确的是( )
胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法,其中正确的是( ) 和CO2反应生成可降解聚合物
和CO2反应生成可降解聚合物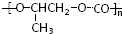 ,该反应符合绿化学的原则.
,该反应符合绿化学的原则.