10.如图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
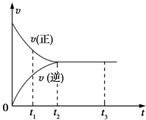

| A. | t1时,只有正方向反应 | B. | t1~t2,X2的物质的量越来越多 | ||
| C. | t2~t3,反应不再发生 | D. | t2~t3,各物质的浓度不再发生变化 |
6.下表中有甲、乙两组物质,可用编号回答下列问题:
(1)甲组中B只能和乙组中③发生反应.
(2)甲组中A和乙组中②可以发生显色反应,此反应可用于两种物质的相互检验.
(3)甲组中A能与乙组中所有物质发生反应.
(4)乙组中①能与甲组中A发生取代反应,与C发生加成反应.
(5)甲组中的一种物质和乙组中的一种物质可以发生缩聚反应生成一种粉红色线型高分子化合物,该反应的方程式为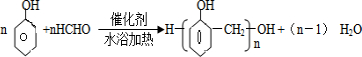 .
.
| 甲 组 | (A)C6H5OH (B)CH3COOCH3 (C)CH3=CHCOOH (D)CH3CH2Br |
| 乙 组 | ①溴水 ②FeCl3溶液 ③NaOH溶液 ④HCHO溶液 |
(2)甲组中A和乙组中②可以发生显色反应,此反应可用于两种物质的相互检验.
(3)甲组中A能与乙组中所有物质发生反应.
(4)乙组中①能与甲组中A发生取代反应,与C发生加成反应.
(5)甲组中的一种物质和乙组中的一种物质可以发生缩聚反应生成一种粉红色线型高分子化合物,该反应的方程式为
 .
.
4.下列是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=9.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO-+CO2+H2O=CO32-+2HClO | |
| C. | 向0.1 mol•L-1CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的pH=5 | |
| D. | 向浓度均为1.0×10-3 mol•L-1的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol•L-1的AgNO3溶液,CrO42-先形成沉淀 |
3.常温下用惰性电极电解1L含足量KCl的溶液,若通过n mol电子的电量,则溶液的pH与n的关系是(设电解前后溶液的体积不变,生成的气体全部逸出)( )
| A. | pH=n | B. | pH=-lg n | C. | pH=14-lgn | D. | pH=lgn+14 |
2.某学习小组的同学在学习了化学反应速率与化学平衡知识后,对反应:aA(g)+bB(g)?cC(g)+dD(g)△H,反应特点与对应的图象展开了讨论,其中不正确的是( )
| A. | 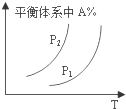 图中,若P1>P2,则该反应在较低温度下有利于自发进行 | |
| B. |  图中,若T2>T1,则△H<0且a+b=c+d | |
| C. | 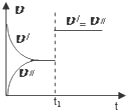 图中(v′表示正反应速率,v″表示逆反应速率),t1时刻改变的条件一定是使用了催化剂 | |
| D. | 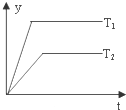 图中,若△H<0,则纵坐标不可能表示的是反应物的转化率 |
1.如图是达到平衡后,外界条件变化时,2SO2(g)+O2(g)?2SO3(g);△H<0反应速率的变化情况(v′表示正反应速率,v″表示逆反应速率).下列说法中正确的是( )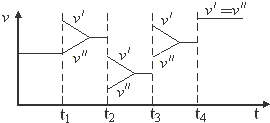
0 167674 167682 167688 167692 167698 167700 167704 167710 167712 167718 167724 167728 167730 167734 167740 167742 167748 167752 167754 167758 167760 167764 167766 167768 167769 167770 167772 167773 167774 167776 167778 167782 167784 167788 167790 167794 167800 167802 167808 167812 167814 167818 167824 167830 167832 167838 167842 167844 167850 167854 167860 167868 203614

| A. | t1时改变的条件是增大体系的压强 | B. | t2时改变的条件是减小压强 | ||
| C. | t3时改变的条件是升高温度 | D. | t4时改变的条件是使用了催化剂 |
 2014年12月6日中国经济网报道,日本东京大学科学家确定了两种新发现的具有高度活性的硅化物SiC2N和SiC3N分子,这项研究将有助于天文学家在星际介质中寻找相关分子.回答下列问题:
2014年12月6日中国经济网报道,日本东京大学科学家确定了两种新发现的具有高度活性的硅化物SiC2N和SiC3N分子,这项研究将有助于天文学家在星际介质中寻找相关分子.回答下列问题: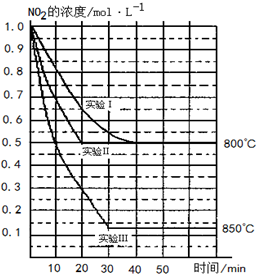 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题: .
.