题目内容
7.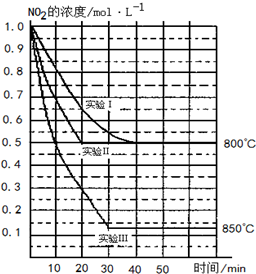 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:(1)实验Ⅱ隐含的反应条件是使用了催化剂.
(2)实验II中,从反应开始至达到平衡,用氧气浓度变化表示的化学反应速率为0.0125mol•L-1•min-1.
(3)800℃时,该反应的平衡常数K=0.25.该反应是吸(填“吸”或“放”)热反应.
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2mol由物质的量之比为1:1组成的NO2与O2混合气体(保持温度不变),此时反应将向向正反应方向进行(填“正反应方向”或“逆反应方向”).
(5)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,如:8NH3+6NO2$\frac{\underline{\;一定条件\;}}{\;}$7N2+12H2O.若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为:2NO2+4CO2+8e-=N2+4CO32-或6NO2+12CO2+24e-=3N2+12CO32-.
(6)向AlCl3溶液中逐滴加入氨水,发生如下反应Al3++3NH3•H2O?Al(OH)3↓+3NH4+,一般认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时,沉淀已完全.已知当溶液中Al3+恰好沉淀完全时溶液的pH=4.7,则Al(OH)3的溶度积常数为1.25×10-33(已知:lg2=0.3).
分析 (1)实验Ⅰ和实验Ⅱ平衡时NO2的浓度相同,但实验Ⅱ反应速率大;
(2)图象中二氧化氮的浓度改变为1.0mol/L-0.5mol/L=0.5mol/L,反应速率v=$\frac{△c}{△t}$计算得到,反应速率之比等于化学方程式计量数之比计算得到氧气表示的反应速率;
(3)化学平衡常数为生成物浓度幂之比与反应物浓度幂之比的比,由图可知,温度越高,平衡时NO2的浓度越小;
(4)根据平衡常数和浓度商判断平衡移动,实验Ⅰ中达平衡后,c(NO2)=0.5mol/L,
2NO2(g)?2NO(g)+O2(g)
开始(mol/L):1 0 0
变化(mol/L):0.5 0.5 0.25
平衡(mol/L):0.5 0.5 0.25
平衡常数k=$\frac{{c}^{2}(NO)×c({O}_{2})}{{c}^{2}(N{O}_{2})}$=0.25;
(5)利用氧化还原反应分析发生的化学反应,8NH3+6NO2$\frac{\underline{\;一定条件\;}}{\;}$7N2+12H2O.若将此反应设计成原电池,融熔K2CO3为电解质,正极是二氧化氮得到电子发生还原反应;
(6)依据溶液pH计算溶液中氢离子浓度,结合溶度积常数计算氢原子氢氧根离子浓度,溶度积常数Ksp=c3(OH-)c(Al3+)计算得到.
解答 解:(1)因实验Ⅰ和实验Ⅱ平衡时NO2的浓度相同,但实验Ⅱ反应速率大,则实验Ⅱ使用了催化剂,故答案为:使用了催化剂;
(2)实验Ⅱ达到平衡所需时间为20min,图象中二氧化氮的浓度改变为1.0mol/L-0.5mol/L=0.5mol/L,二氧化氮的反应速率v=$\frac{△c}{△t}$=$\frac{0.5mol/L}{20min}$=0.025mol/L,反应速率之比等于化学方程式计量数之比计算得到氧气表示的反应速率=$\frac{1}{2}$V(NO2)=$\frac{1}{2}$×0.025mol/L=0.0125mol•L-1•min-1;
故答案为:0.0125mol•L-1•min-1;
(3)由反应2NO2(g)?2NO(g)+O2(g),则K=$\frac{{c}^{2}(NO)×c({O}_{2})}{{c}^{2}(N{O}_{2})}$,实验Ⅰ中达平衡后,c(NO2)=0.5mol/L,
2NO2(g)?2NO(g)+O2(g)
开始(mol/L):1 0 0
变化(mol/L):0.5 0.5 0.25
平衡(mol/L):0.5 0.5 0.25
平衡常数k=$\frac{{c}^{2}(NO)×c({O}_{2})}{{c}^{2}(N{O}_{2})}$=$\frac{0.25×0.{5}^{2}}{0.{5}^{2}}$=0.25,
又温度越高,平衡时NO2的浓度越小,则正反应为吸热反应,
故答案为:0.25;吸;
(4)实验Ⅰ中达平衡后,c(NO2)=0.5mol/L,
2NO2(g)?2NO(g)+O2(g)
开始(mol/L):1 0 0
变化(mol/L):0.5 0.5 0.25
平衡(mol/L):0.5 0.5 0.25
平衡常数k=$\frac{{c}^{2}(NO)×c({O}_{2})}{{c}^{2}(N{O}_{2})}$=0.25,
通入2mol由物质的量之比为1:1组成的NO2与O2混合气体(保持温度不变),
此时为c(NO2)=0.5mol/L+$\frac{1mol}{2L}$=1mol/L,c(NO)=0.5mol/L,c(O2)=0.25mol/L+$\frac{1mol}{2L}$=0.75mol/L,
浓度商为Qc=$\frac{{c}^{2}(NO)×c({O}_{2})}{{c}^{2}(N{O}_{2})}$=$\frac{0.{5}^{2}×0.75}{{1}^{2}}$=0.1825<0.25,平衡向右移动,
故答案为:向正反应方向;
(5)8NH3+6NO2$\frac{\underline{\;一定条件\;}}{\;}$7N2+12H2O.若将此反应设计成原电池,融熔K2CO3为电解质,因氨气具有还原性,NO2具有氧化性,由氧化还原反应转化为无毒的氮气可排放在环境中,氧化还原反应为8NH3+6NO2=7N2+12H2O形成原电池反应正极上是二氧化氮得到电子生成氮气,电极反应为:2NO2+4CO2+8e-=N2+4CO32-或6NO2+12CO2+24e-=3N2+12CO32-;
故答案为:2NO2+4CO2+8e-=N2+4CO32-或6NO2+12CO2+24e-=3N2+12CO32-;
(6)已知当溶液中Al3+恰好沉淀完全时溶液的pH=4.7,溶液中氢氧根离子浓度c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4.7}}$=10-9.3mol/L=$\frac{1{0}^{-9}}{1{0}^{0.3}}$mol/L=$\frac{1×1{0}^{-9}}{2}$mol/L=5×10-5mol/L,一般认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时,沉淀已完全,则Al(OH)3的溶度积常数为Ksp=c3(OH-)c(Al3+)=(5×10-10)3×1×10-5 =1.25×10-33mol4•L-4;
故答案为:1.25×10-33mol4•L-4.
点评 本题考查图象与化学平衡,原电池原理分析,溶度积常数、平衡常数的计算分析,明确影响化学平衡的因素及图象中量的是解答本题的关键,注意利用K与Q来分析平衡移动的方法,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | C4H10有三种同分异构体 | |
| C. | 氨基酸、淀粉均属于高分子化合物 | |
| D. | 乙烯和甲烷可用溴的四氯化碳溶液鉴别 |
| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 当溶液中的氨基酸主要以两性离子的形态存在时,它在水中的溶解度最小,可以形成晶体析出.不同的氨基酸出现这种情况的pH各不相同,利用这一差别,可以通过调节溶液pH分离某些氨基酸 | |
| C. | 有机硅聚醚 (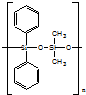 )可由单体 )可由单体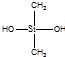 和 和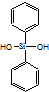 缩聚而成 缩聚而成 | |
| D. | 等质量的甲醇、甲醛、二甲醚完全燃烧时的耗氧量依次递增 |
| A. | 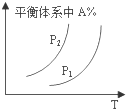 图中,若P1>P2,则该反应在较低温度下有利于自发进行 | |
| B. |  图中,若T2>T1,则△H<0且a+b=c+d | |
| C. | 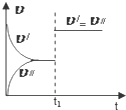 图中(v′表示正反应速率,v″表示逆反应速率),t1时刻改变的条件一定是使用了催化剂 | |
| D. | 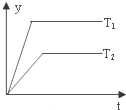 图中,若△H<0,则纵坐标不可能表示的是反应物的转化率 |
 科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )| A. | 分子中不含有非极性键 | B. | 1mol该分子中含8mol二氧化氮 | ||
| C. | 该物质既有氧化性又有还原性 | D. | 该物质爆炸产物是NO2、C02、H20 |
| A. | 工业上制取玻璃的工艺是应用了物质酸性的差异 | |
| B. | 家庭里可用淀粉检验加碘盐是否含有碘 | |
| C. | 铁是人体必需的微量元素,所以可以适当地吃点铁锈 | |
| D. | 王水是由浓盐酸和浓硝酸两种物质按3:1的体积比混合配制成的 |
| A. | 53.8% | B. | 58.3% | C. | 60.3% | D. | 70.0% |
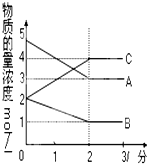 在恒容密闭容器中,某反应在不同反应时间各物质的量浓度的变化情况如图所示(各物质均为气体).请回答下列问题:
在恒容密闭容器中,某反应在不同反应时间各物质的量浓度的变化情况如图所示(各物质均为气体).请回答下列问题: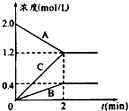 表示800℃时含有A、B、C三种气体的体系中各物质浓度(mol/L)随时间变化的情况如图所示
表示800℃时含有A、B、C三种气体的体系中各物质浓度(mol/L)随时间变化的情况如图所示