题目内容
3.常温下用惰性电极电解1L含足量KCl的溶液,若通过n mol电子的电量,则溶液的pH与n的关系是(设电解前后溶液的体积不变,生成的气体全部逸出)( )| A. | pH=n | B. | pH=-lg n | C. | pH=14-lgn | D. | pH=lgn+14 |
分析 常温下用惰性电极电解1L含足量KCl的溶液,发生电极反应为:阳极:2Cl--2e-=Cl2↑,阴极:2H2O+2e-=H2↑+2OH-,结合反应可计算出电解后的溶液中的氢氧根离子浓度,再结合水的离子积计算出溶液中氢离子浓度,最后计算出溶液的pH.
解答 解:电解过程的电极反应式为:阳极:2Cl--2e-=Cl2↑,阴极:2H2O+2e-=H2↑+2OH-,
生成的氢氧根离子与转移的电子的物质的量相等,则通过n mol电子的电量时生成了nmol氢氧根离子,
电解后得到溶液的氢氧根离子浓度为nmol/L
则c(H+)=$\frac{1{0}^{-14}}{n}$,所以溶液的pH=-lg$\frac{1{0}^{-14}}{n}$,=lgn+14,
故选D.
点评 本题考查了溶液pH的计算,题目难度中等,根据电极反应式找出转移电子与氢氧根离子的物质的量关系为解答关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.2,2-二甲基对三联苯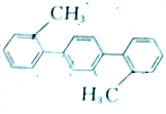 的一氯代物有(不考虑空间异构)( )
的一氯代物有(不考虑空间异构)( )
 的一氯代物有(不考虑空间异构)( )
的一氯代物有(不考虑空间异构)( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 14种 |
14.下列描述中正确的是( )
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中的空间构型为正四面体形 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
18.中学阶级介绍的电解原理的应用主要有三种:一是氯碱工业、二是电解精炼铜、三是电解冶金.下列关于这三个工业生产的描述中正确的是( )
| A. | 电解精炼铜时,负极反应式:Cu2++2e-=Cu | |
| B. | 氯碱工业和电解精炼铜中,阳极都是氯离子放电放出氯气 | |
| C. | 在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生 | |
| D. | 电解精炼铜时,应用粗铜作阳极、精铜作阴极,可溶性铜盐作电解质溶液 |
15.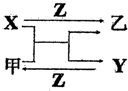 X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )
 X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )| A. | X、Y、Z一定都是非金属单质 | B. | X、Y、Z一定都是金属单质 | ||
| C. | X、Y、Z中至少有一种是非金属单质 | D. | X、Y、Z中至少有一种是金属单质 |
12.我们熟知的一些化合物的应用错误的是( )
| A. | MgO用于冶炼金属镁 | B. | NaCl用于制纯碱 | ||
| C. | Cu(OH)2用于检验糖尿病 | D. | FeCl3用于净水 |
13.正丁醛经催化加氢可制备1-丁醇.为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:
粗品$→_{操作1}^{饱和NaHSO3溶液}$滤液$→_{萃取}^{乙醛}$操作2有机层$→_{操作3}^{固体干燥剂}$1-丁醇乙醚(操作4)纯品
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃.则操作1~4分别是( )
粗品$→_{操作1}^{饱和NaHSO3溶液}$滤液$→_{萃取}^{乙醛}$操作2有机层$→_{操作3}^{固体干燥剂}$1-丁醇乙醚(操作4)纯品
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃.则操作1~4分别是( )
| A. | 萃取、过滤、蒸馏、蒸馏 | B. | 过滤、分液、蒸馏、萃取 | ||
| C. | 过滤、蒸馏、过滤、蒸馏 | D. | 过滤、分液、过滤、蒸馏 |
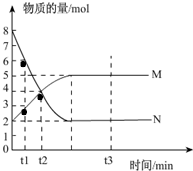 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: