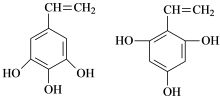
题目内容
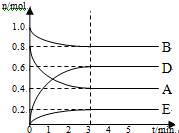
1.如图是达到平衡后,外界条件变化时,2SO2(g)+O2(g)?2SO3(g);△H<0反应速率的变化情况(v′表示正反应速率,v″表示逆反应速率).下列说法中正确的是( )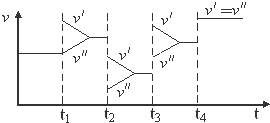
| A. | t1时改变的条件是增大体系的压强 | B. | t2时改变的条件是减小压强 | ||
| C. | t3时改变的条件是升高温度 | D. | t4时改变的条件是使用了催化剂 |
分析 A、增大体系的压强,正逆反应速率立即增大,平衡2SO2(g)+O2(g)?2SO3(g)正向移动,正反应速率大于逆反应速率;
B、减小压强,正逆反应速率立即减小,平衡2SO2(g)+O2(g)?2SO3(g)逆向移动,逆反应速率大于正反应速率;
C、升高温度,正逆反应速率迅速增大,逆反应速率大于正反应速率,平衡2SO2(g)+O2(g)?2SO3(g)逆向移动;
D、催化剂只能加快反应速率,但是不改变平衡的移动.
解答 解:A、增大体系的压强,正逆反应速率立即增大,应离开原来的速率点,平衡2SO2(g)+O2(g)?2SO3(g)正向移动,正反应速率大于逆反应速率,故A错误;
B、t2时减小压强,正逆反应速率立即减小,平衡2SO2(g)+O2(g)?2SO3(g)逆向移动,此时逆反应速率大于正反应速率,v″大于v′,故B错误;
C、t3时升高温度,正逆反应速率迅速增大,逆反应速率大于正反应速率,平衡2SO2(g)+O2(g)?2SO3(g)逆向移动,v″大于v′,故C错误;
D、催化剂只能加快反应速率,但是不改变平衡的移动,故D正确.
故选D.
点评 本题考查化学反应速率、化学平衡的影响因素,难度不大,注意反应速率的变化以及平衡移动之间的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列过程中化学键没有被破坏的是( )
| A. | 二氧化碳溶于水 | |
| B. | 氯化钠溶于水 | |
| C. | 水沸腾汽化 | |
| D. | 煤矿中瓦斯(主要成分是甲烷)遇火爆炸 |
16.化学与工农业生产、环境保护、日常生活等方面有广泛联系,下列叙述正确的是( )
| A. | 将草木灰和硫铵混合使用,相当于施用了氮和钾的复合肥料,提高了肥料利用率 | |
| B. | 铝制容器不能长期盛装酸性或碱性食品,但可用于长期盛放腌制食品 | |
| C. | 氟里昂(CCl2F2)或NOx都可以破坏臭氧层,从而导致了“温室效应” | |
| D. | 大量使用含磷洗涤剂,可导致水体富营养化 |
6.下表中有甲、乙两组物质,可用编号回答下列问题:
(1)甲组中B只能和乙组中③发生反应.
(2)甲组中A和乙组中②可以发生显色反应,此反应可用于两种物质的相互检验.
(3)甲组中A能与乙组中所有物质发生反应.
(4)乙组中①能与甲组中A发生取代反应,与C发生加成反应.
(5)甲组中的一种物质和乙组中的一种物质可以发生缩聚反应生成一种粉红色线型高分子化合物,该反应的方程式为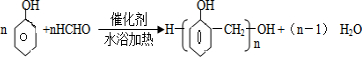 .
.
| 甲 组 | (A)C6H5OH (B)CH3COOCH3 (C)CH3=CHCOOH (D)CH3CH2Br |
| 乙 组 | ①溴水 ②FeCl3溶液 ③NaOH溶液 ④HCHO溶液 |
(2)甲组中A和乙组中②可以发生显色反应,此反应可用于两种物质的相互检验.
(3)甲组中A能与乙组中所有物质发生反应.
(4)乙组中①能与甲组中A发生取代反应,与C发生加成反应.
(5)甲组中的一种物质和乙组中的一种物质可以发生缩聚反应生成一种粉红色线型高分子化合物,该反应的方程式为
 .
.
13.下列说法正确的是( )
| A. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸 | |
| B. | 将0.1mol/L的NaOH溶液与0.5mol/L的CuSO4溶液等体积混合制得氢氧化铜悬浊液,用于检验麦芽糖是还原性糖 | |
| C. | 在密闭容器中加入1.5mol H2和0.5mol N2充分反应可得到NH3分子数为NA | |
| D. | 标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA |
10.可确定乙二醇分子是否有极性的实验是( )
| A. | 测定沸点 | B. | 测静电对液流影响 | ||
| C. | 测定蒸气密度 | D. | 测标准状况下气体摩尔体积 |
11.设NA代表阿伏加德罗常数的数值,下列说法中正确的是;( )
| A. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| B. | 常温下,16gO2和O3的混合气体中含有的氧原子数为NA | |
| C. | 标准状况下,22.4L NO和22.4LO2 混合后所得气体中分子总数为1.5NA | |
| D. | 将11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
 某温度T℃下,在某个固定容积为2.0L的密闭容器内,在时按右图所示发生反应:其中A、B、D为气体,E为固体.
某温度T℃下,在某个固定容积为2.0L的密闭容器内,在时按右图所示发生反应:其中A、B、D为气体,E为固体.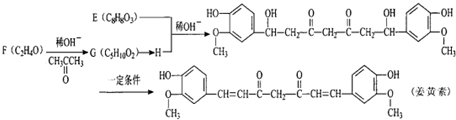
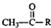 $\stackrel{稀OH-}{→}$
$\stackrel{稀OH-}{→}$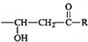
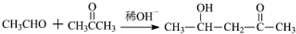 ,G→H的反应类型为氧化反应
,G→H的反应类型为氧化反应 ;将F滴人新制Cu(OH)2悬浊液,加热,观察到的现象是出现红色沉淀
;将F滴人新制Cu(OH)2悬浊液,加热,观察到的现象是出现红色沉淀